【Serumwerk】沙粒病毒科(Arenaviridae)纯化
沙粒病毒科纯化不成功、实验做不出来怎么办?新手小白迫切求助,希望各位前辈在文章下方留言,分享自己的经验,为小白们答疑解惑!
溶液制备
A. OptiPrep™
B. 磷酸盐缓冲盐水
C. 梯度溶液:用溶液B稀释OptiPrep™,得到7.2和18% (w/v)碘克沙醇密度溶液
试验方法
1.从澄清的细胞培养上清中提取病毒悬液,通过密度屏障将其制成颗粒,浓缩病毒悬液,并将其重新悬浮在小体积的溶液B中。
2.使用双腔梯度标记器或Gradient Master™从两种碘克沙醇溶液各约6ml中制备连续梯度。
3.将粗提病毒悬浮液(1.0-1.5 ml)分层置于梯度上方并以200,000 gav在4℃下离心1.5 h。
4.首先以约0.8-1.0 ml的低密度端向上位移收集梯度。在约14% (w/v)碘克沙醇时,病毒条带急剧增加。
方法注释
1.如果没有梯度制造装置,则配制7.0%、10%、13%、16%和19% (w/v)碘克沙醇溶液。
2.Lenz等人通过20%蔗糖缓冲层(在48,000 gav下2小时)将拉沙病毒制成颗粒;为了维持病毒的等渗环境,可以用15% (w/v)碘克沙醇替代20%的蔗糖。理想的浓缩病毒的方法是沉淀在碘克沙醇的致密垫层上,而不是造粒。然而,在这种情况下,碘克沙醇在病毒悬液中的浓度需要为5% (w/v)才能加载到梯度上时,这种方法可能不太方便。在回收病毒带时,必须尽可能少地抽吸缓冲液。
3.或者从等体积的7.0%、10%、13%、16%和19% (w/v)碘克沙醇形成一个不连续梯度,并允许通过扩散形成一个连续梯度(在室温下放置5小时,或在4°C放置过夜)。
4.通过检查空白梯度的密度确认梯度是连续的。
5.Dettenhoffer和Yu引入了HIV-1的沉降速度策略,他们以1.2%的碘克沙醇浓度区间将溶液分层,制备了“基本上连续”的梯度。
6.如果要纯化较大体积的粗病毒,则必须使用较大体积梯度。由于这是速率分区分离,因此粗制病毒悬液的体积不应超过梯度体积的10-15%。
7.如果要在更高的温度下进行分离,则可能需要减少离心时间以考虑梯度的降低粘度。
8.通过导管穿刺收集梯度可能是一种有用的替代方法。
淋巴细胞性脉络丛脑膜炎病毒(LCV)纯化
在7%、10%、13%、16%和19% (w/v)碘克沙醇扩散产生的连续梯度中纯化LCV,在122,000 g离心12 h。
塔卡里伯病毒(Tacaribe virus)纯化
在含有k -天冬氨酸、k -谷氨酸和k -葡萄糖酸盐(均为38 mM)、10 mM KHCO3、2mM MgCl2(或5 mM EDTA)、2mM DTT、10μM ZnCl2和20 mM MOPS pH 7.1(加蛋白酶抑制剂)的培养基中,通过Dounce匀浆或添加去污剂(2% NP40)将含病毒的细胞裂解。15-48% (w/v)碘克沙醇梯度(含有与溶解培养基相同的试剂)形成于5 ml管用于摇桶转子;使用梯度前或允许不连续梯度(等体积的15%、26%、37%和48%碘克沙醇)扩散。在将样品调整为50% (w/v)碘克沙醇后,将其在连续梯度下分层并在100,000 g下离心20 h。
相关产品推荐
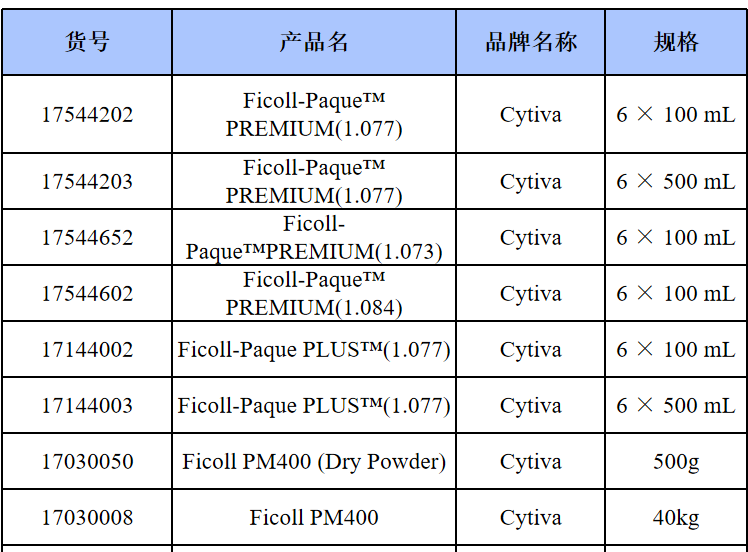
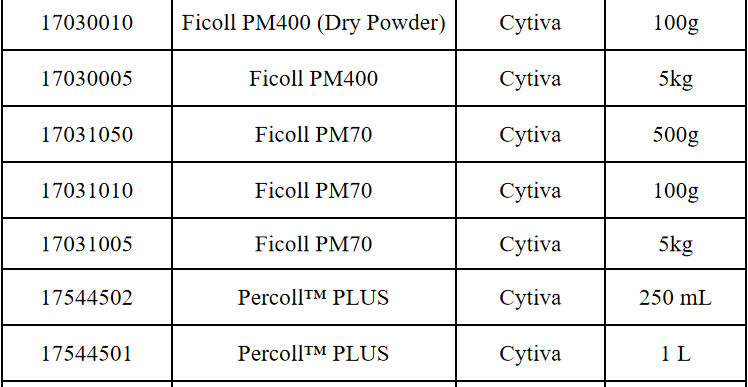
其他细胞品类
别划走,精彩继续

长按识别
添加一对一专属技术支持

扫码进群
咨询详细产品信息

点在看,传递你的品味












