【Miltenyi】美天旎磁珠分选经验
MACS分选柱介绍
MACS分选柱作为MACS磁分选技术的核心部分,内部填充专利的超顺磁铁珠。基于其独特设计和内部基质构造使用MACS分选柱能获得高纯度、高活力的目的细胞,从而为细胞分选提供理想的解决方案,并且不受细胞类型或样本体积限制。
●仅用最少量的纳米级磁珠标记,就足以高效分离目的细胞
●细胞可以自由流出,过程温和
●便于向临床应用转化,基于MACS技术的CliniMACS® CD34试剂系统,已通过美国FDA认证
选择最满足应用的分选柱是关键,方能在保证高纯度的同时实现高回收率。
为了选择最适分选柱,您首先需要考虑如下几个问题:
1.您使用MACS Cell lsolation还是MACS MicroBeads?
2.目的细胞类型是常见细胞还是罕见细胞? 抗原表达强还是弱?
3.您需要分选多少细胞?
磁珠分选经验
(一) 你要分选多少细胞呢?
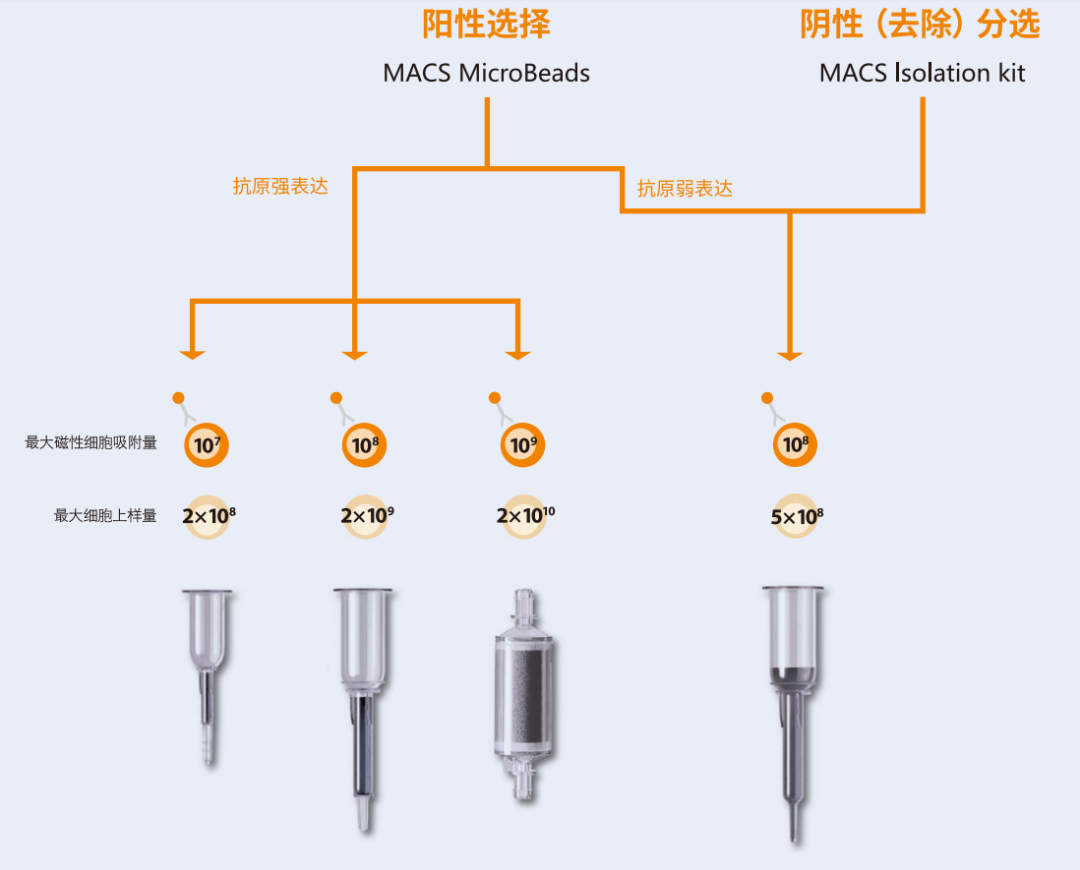
可参考下表来选择合适的分选柱
分选柱 | 最大磁性细胞吸附量(cells) | 最大细胞上样量(cells) |
MS | 107 | 2x108 |
LS | 108 | 2x109 |
XS | 109 | 2x1010 |
LD | 108 | 5x108 |
CS | 2x108 | 109 |
D | 109 | 1011 |
注:在分选 CD133 相关细胞时,最大磁性细胞吸附量和最大细胞上样量和上表有较大差别
(二)稀有细胞如何分选?
通常表达频率<5%被认为是稀有细胞,在阳性分选中连续使用2个分选柱,可实现更高的分选纯度:用一根分选柱做第一次分选,阳性成分再过一次新的分选柱。
(三)有没有可以用于全血的分选柱和磁珠呢?
有的,目前有可以用于人全血的分选柱和分选磁珠,可以一次性分选 0.25-15mL 的全血。
使用美天旎Whole Blood全血磁珠来分选目的细胞,不需要进行红细胞裂解,亦无须进行密度梯度离心步骤。
全血磁珠大大简化了您的实验流程,并且最大限度减少手动操作步骤,从而保证了在最短时间内获得高回收率、高活性的目的细胞。此外,由于省去了离心步骤,操作更安全,尤其是处理未经检测的血样。值得一提的是whole Blood全血磁珠也可以用于骨髓样本中目的细胞的分离。
●分选过程温和,获得的目的细胞得率高、活性好
●操作更安全,尤其对于危险的血液样本
●操作流程简单,节省时间
纯化后的细胞适用于下游实验,包括流式分析、细胞分选、以及体外实验等。
目前美天旎Whole Blood全血磁珠产品可用于CD3+、CD4+、CD8+、CD14+、CD15+、CD19+、CD33+、CD45+、CD56+、CD66b+和CD138+细胞的分选
(四)大细胞、植物细胞,有相应的分选方案推荐吗?
Large Cell column专门用来分选植物细胞、原生动物或者比较大的哺乳动物细胞,如皮肤朗格汉斯细胞、巨核细胞和神经元等。
(五)MS 和 LS 分选柱只能用于阳性分选吗?
这个不一定的,比如在抗原表达量比较高的情况下,如果是以回收率为优先考虑的话,是可以使用 MS 或 LS 进行阴性分选,如果是以纯度指标为优先考虑的话,要使用 LD,CS 或 D 柱进行阴性分选,如果各位小伙伴觉得会搞混的话,也不用担心,说明书上都会有明确的提示,大家严格按照提示操作就行。
(六)分选后的细胞可以直接流式检测吗?
可以的,利用美天旎磁珠分选后的细胞表面抗原只占据了 20-30%左右,还留有一大部分的抗原表位可以供流式抗体结合,所以是没有问题的。
(七)俗话说,细节决定成败!注意实验细节有助于提高实验成功率哦,下面就为大家列举一些常见的磁珠分选的问题,快来围观吧!
A 待分选细胞中如有贴壁细胞,建议在分选前先贴壁培养去除,或者提高 EDTA 浓度,柱子堵了心也堵了。
B 抗体包被的磁珠对死细胞常有非特异性结合,因而分选前应看细胞活率并去除死细胞,对纯度不满意,看看细胞活度吧。
C 新鲜分离骨髓细胞,先用胶原酶、DNA 酶、胰酶联合消化,可使细胞团块解聚,得到更好的但细胞悬液,从而提高磁珠与细胞的结合效率及最终的分离效率,提高纯度和得率。
D 上分离柱前,充分振荡,混悬细胞,打散细胞团块,使之分散成单细胞悬液,过滤一下很重要。
E 用分离柱分选时,应用真空抽滤水;滴加细胞悬液或洗液时也应注意轻柔滴入,减少气泡的产生,避免分离柱被气泡阻滞影响流出速度,重复使用分选柱,这种方式要不得。
F 细胞悬液加入分离柱中时,应将滴管伸至底壁后加入,不要将细胞悬液沿管壁流入,使分选前的细胞残留在管壁上,导致后继洗柱过程中,因疏忽未被洗下,最后导致纯度不高。洗柱时,应在前次液体充分流尽后,再加洗液。
G 分选细胞量应根据说明书控制,不超量,超量只会更苦恼。
H 孵育时间和温度应按说明书进行,延长孵育时间、提高温度会增加非特异结合。
I 先用抗体阻断 Fc 受体,可降低非特异性结合。
分选方法解析
做磁珠分选,大家首先要根据自己的实验目的与指标来选择是用阳选、阴选还是复合分选
- | 流式分选 | 磁珠分选 |
分选速度 | 约104cell/s | 107cell/s |
分选纯度 | >90% | 80-90% |
多参数分选 | 可同时进行多参数分选,例如CD4+CD25+CD127low的Treg,三色的一次就能分选 | 阳选每次只能根据一个参数,例如CD3+和 CD4+双阳细胞,必须先分离CD4,再分离CD3,亦可进行多种细胞的阴选。 |
胞内指标分选 | 可以 | 不可以 |
技术难度 | 需要流式仪,调节仪器参数,技术难度高 | 不需要专业设备,仅需磁性分离器 |
对细胞的影响 | 对细胞刺激大,易污染 | 对细胞刺激小 |
所需物品 | 流式细胞仪、标准微粒、荧光抗体 | 磁性分离器、磁珠、生物素抗体 |
综上,对于分选细胞数量多,或者没有流式仪器,再或者需要保持细胞高活力的小伙伴们,磁珠分选是大家首选的方法。
阳性分选:运用特异性抗体偶联磁珠直接从细胞混合物中分离目的细胞的分选方法称为 positive selection。阳性分选中磁珠标记的细胞即为目的细胞。该法简单、快速、细胞得率和纯度较高。如采用 anti-CD14 磁珠分选 CD14+巨噬细胞。
阴性分选(也叫去除分选):用抗体偶联磁珠去除无关细胞,使目的细胞得以纯化和分离的分选方法称为 negative selection。阴性分选中磁珠标记的细胞为非目的细胞。阴性分选法适用于:
①从细胞混合物中去除某种类型细胞。如肿瘤细胞;
②缺乏针对目的细胞筛选的特异性抗体,如肿瘤细胞 ;
③抗体和目的细胞结合可能诱导细胞活化,影响后续细胞功能分析。
复合分选:将阴性分选和阳性分选相结合的分选方法。复合分选适用于:
①选非常稀有细胞,可采用阴性分选法先去除其他杂细胞,再采用阳性分选筛选目的细胞;
②非目的细胞也表达用来阳性选择的抗原。
③降低细胞分选的成本,与流式分选联合使用。
其他细胞品类
别划走,精彩继续

长按识别
添加一对一专属技术支持

扫码进群
咨询详细产品信息

点在看,传递你的品味












