【Cytiva】Percoll 细胞分离液——Percoll 密度梯度离心介质
产品信息

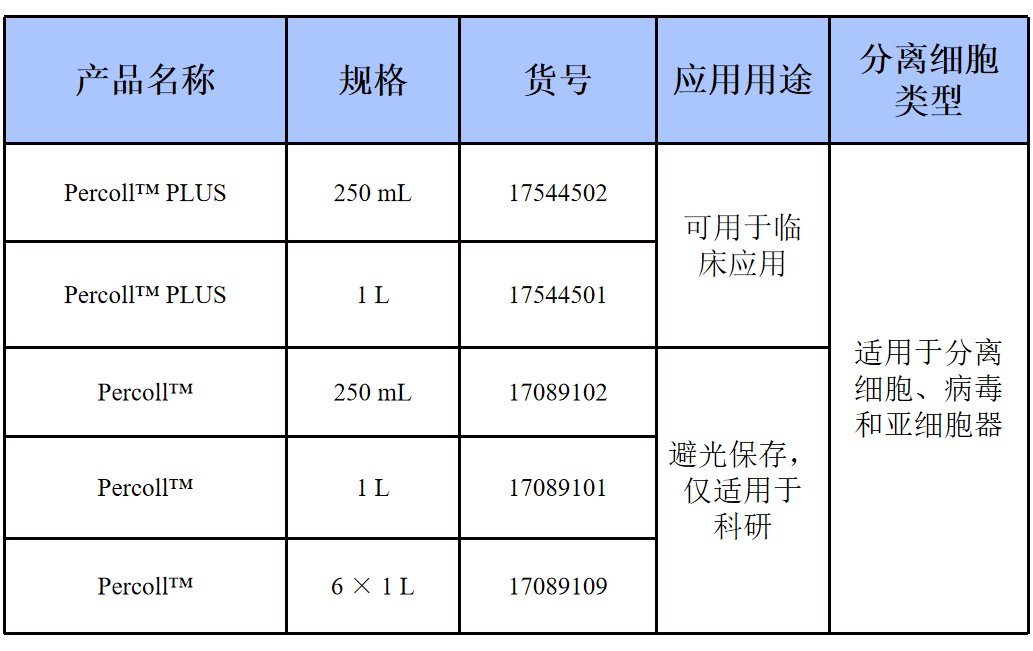
产品介绍
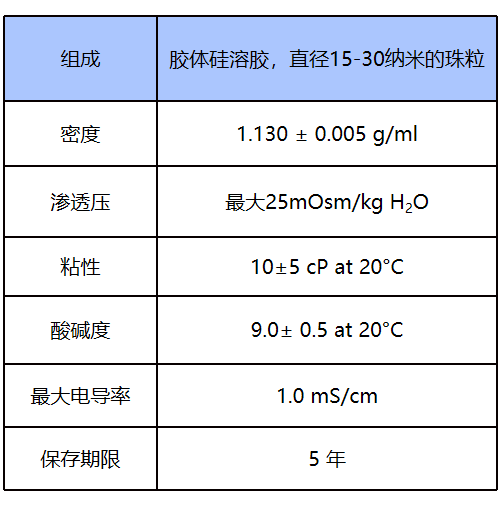
Percoll由涂有聚乙烯吡咯烷酮(PVP)的胶体二氧化硅组成,具有低粘度、低渗透压、无细胞毒性的特点,是一种适用于细胞、病毒和亚细胞颗粒的密度梯度离心沉淀的介质。用于在温和的条件下分离细胞、亚细胞颗粒和较大的病毒(低至 ~ 70 S),以保留活力和形态完整性。Percoll可以预先形成梯度,也可以通过在角头转子中以中等速度离心沉淀自发产生梯度。整个梯度覆盖的密度范围高达 1.3g/mL。但Percoll 仅能用于科研。
Percoll Plus是共价偶联烷硅涂层硅胶,性质更加稳定,内毒素含量较低(<2EU/ml),有法规文件支持,可以用于临床研究。
Percoll分层液法是一种连续密度梯度离心分离法。利用Percoll液经高速离心后形成一个连续密度梯度的原理,将密度不等的细胞分离纯化。用Percoll原液(密度1.135)与约等量双离子强度的磷酸缓冲液均匀混合,高速离心后,使分层液形成一个从管底到液面密度逐渐递减的连续密度梯度,再将已制备的单个核细胞悬液轻轻叠加在液面上,低速离心后,便得四个细胞层。表层为死细胞残片和血小板,底层为粒细胞和红细胞,中间有两层,上层富含单个核细胞(75%),下层富含淋巴细胞(98%)。该法是纯化单核细胞和淋巴细胞的一各较好的方法,但操作流程较长,手续较多。
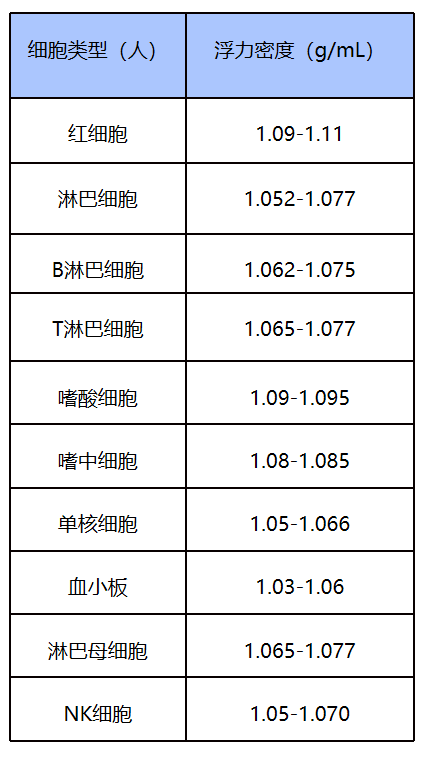
Percoll作为通用细胞分离液,应用范围广,可稀释成不同浓度,用来分离各种类型细胞,还可分离亚细胞器和病毒,如:中性粒细胞,单核细胞,肿瘤浸润淋巴细胞,巨噬细胞,病毒等,实现从1.02-1.3 g/ml范围内的密度梯度离心分离。等渗透Percoll梯度形成于1.0-1.3g/ml范围内,适用于多数细胞分离;亚细胞器和较大的病毒在Percoll中浮力密度为1.0-1.2g/ml。
表1 Percoll PLUS规格
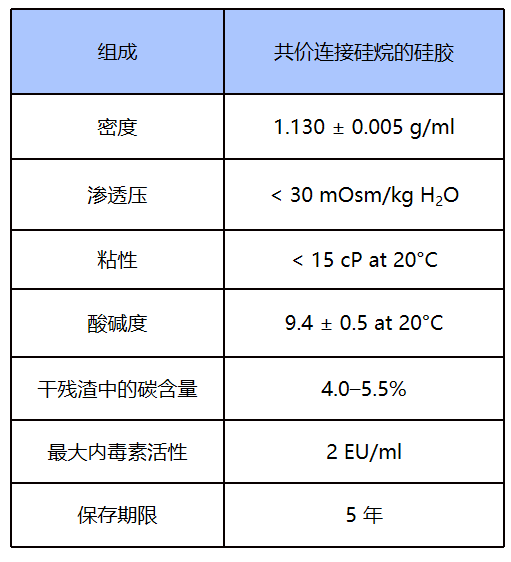
表2 Percoll 规格
Percoll/Percoll PLUS 在生产过程中是经过高温灭菌处理的,但是由于瓶子的材质问题,只能在 113℃ 条件下进行,持续时间为 1 h。目前在官方说明书中不再申明 Percoll/Percoll PLUS 为无菌的。如果对灭菌要求较高,可以进一步灭菌,条件是120℃,30 min,但需要从原包装瓶中转移出来。Percoll 溶液的高压灭菌必须在没有盐和蔗糖时进行(建议只对原液灭菌)。
Percoll 在没有被打开时,在室温下可以保存5年,打开后应该保存在2℃-8℃,尽快用完。Percoll 可以冷冻保存在-18°C中6个月,如果保存在-18°C,在融化时会形成梯度,在使用前必须混合瓶中的内含物。Percoll 的pH 大约为9.0,在不改变任何性质下可调节为5.5 到10.0。如果pH 降低到5.5以下,可能发生胶凝作用。在存在二价阳离子时也会导致凝胶作用,升高温度会加剧这种作用。
Percoll 密度梯度离心介质
一种低粘度、无毒介质,适用于细胞、病毒和亚细胞颗粒的密度梯度离心沉淀。
●由涂有聚乙烯吡咯烷酮 (PVP) 的胶体二氧化硅组成,渗透压和粘度低。
●用于在温和的条件下分离细胞、亚细胞颗粒和较大的病毒(低至 ~ 70 S),以保留活力和形态完整性。
● 对细胞无毒。
●可根据生理离子强度和 pH 进行调节。
●可以预先形成梯度,也可以通过在角头转子中以中等速度离心沉淀自发产生梯度。
●整个梯度覆盖的密度范围高达 1.3g/mL。
Percoll 是一种低粘密度梯度离心介质,用于制备细胞、亚细胞颗粒和较大的病毒。利用该介质的低粘度,可以在几分钟内使用低离心力(200 至 1000 × g)以预先形成的梯度制备细胞。该介质可装在易于打开、可重新密封的 250 mL 和 1 L 瓶中。
Percoll 由涂有不可透析聚乙烯吡咯烷酮 (PVP) 的二氧化硅颗粒(直径为 15 至 30 nm)组成。游离 PVP 的含量仅为 1%至 2%。Percoll 无毒,几乎呈化学惰性,并且不粘附在膜上。Percoll 梯度可以在 1.0 至 1.3g/mL 的密度范围内形成,并且在整个过程中都等渗。
Percoll 可以在未开封情况下室温保存五年。在 -20°C 下,只能保存最多六个月。
如果在 -20°C 下储存,则在融化时会形成梯度,因此在使用前必须将瓶子混合。只要梯度未冻结,预先形成的梯度可以存储数周,而不会改变梯度形状。
Percoll 可以在 pH 值范围 5.5 至 10 的溶液内使用,而不改变其特性。如果 pH 值降至 5.5 以下,则可能发生凝胶作用。二价阳离子的存在也可能引起凝胶作用,温度升高会加剧这种作用。
未稀释的 Percoll 可在 120℃,30 分钟的条件下,重复高压灭菌。
应用范围
应用物种范围:人,狗,鼠,牛,马,小鼠,大鼠,兔,猪,仓鼠,猕猴,猫,鳟鱼,狨,植物,微生物,真菌,病毒。
常见细胞类型参考密度范围
及配制方法
方法一
按照百分比用两步法计算:用一份的 1.5M NaCl 或者 2.5M 蔗糖加九份 Percoll 原液,得到 100% 的SIP溶液。在此基础上,比如想要得到44%和67%的工作液,分别按0.15M的NaCl 或者0.25M的蔗糖:SIP=(100-44):44和(100-67):67的比例取相应体积的溶液进行配制即可。

方法二
根据密度进行一步法计算,该计算方法需要知道最终配制的溶液的密度、细胞分离液的密度(Percoll 密度范围 1.13±0.005 g/ml,具体密度可根据批次号在英文官网中查询 COA 获得),以及用于稀释的buffer的密度(1.5M的NaCl 密度为1.058 g/ml,2.5M的蔗糖的浓度为1.316 g/ml),推荐官网的计算小程序,链接如下:
https://www.cytivalifesciences.com.cn/zh/cn/support/online-tools/cell-preparation/Percoll-calculator

方法步骤
Percoll PLUS/Percoll可以通过使用方便的梯度混合器或高速离心来形成梯度。在使用高速离心时,样品可以与介质预混合,然后在原位产生的梯度上进行分离,在一次操作中实现梯度形成和样品分离。
(一)梯度材料制备
制备梯度材料Percoll PLUS/Percoll最好用平衡盐溶液、生理盐水或0.25 M蔗糖。细胞可以在平衡的盐溶液中以梯度分离。然而,亚细胞颗粒往往在有盐存在的情况下聚集,建议这些颗粒在Percoll PLUS/Percoll用蔗糖稀释(最终浓度为0.25M)中进行分离。Percoll PLUS/Percoll的低渗透压允许用户控制该参数,而不受密度介质本身的显著干扰。将9份Percoll原液(v/v)加入1份1.5 M氯化钠、10倍浓缩细胞培养基或2.5 M蔗糖(v/v),将溶液调整到约340 mOsm/kg水。通过调节Percoll PLUS/Percoll和盐或蔗糖溶液的相对体积,可以产生不同渗透压的溶液。对所需渗透压的最终调整可以通过添加盐或蒸馏水来进行。当需要精确的渗透压时,建议用渗透计测量溶液的渗透压。
Percoll PLUS/Percoll在15分钟后在固定角度转子中以约10000gav(0.15M生理盐水中)或25000gav(0.25M蔗糖中)离心,形成自然的梯度。细胞或亚细胞颗粒可以在离心前与Percoll PLUS/Percoll混合,并在原位形成梯度。虽然Percoll PLUS/Percoll最好用于角头转子,但在摆动转子中,预先成型(连续或不连续)梯度的细胞带可以在400 gav的条件下进行20-30分钟。所有用Percoll的实验都可以用Percoll PLUS进行。
(二)离心后去除Percoll
由于Percoll对生物材料无毒,并且不粘附在膜上,因此通常不需要从纯化制剂中去除Percoll。细胞可以直接转移到细胞培养系统中[1,2],病毒传染性不受损害[3],细胞器可以用于代谢研究[3],而不会受到梯度材料的任何影响。如果需要,可以使用以下方法来消除梯度材料。
洗涤(低速离心):用生理盐水(5体积生理盐水:1体积Percoll细胞悬液)洗涤,将活细胞从Percoll培养基中分离出来。可重复洗涤2 - 3次,每次洗涤之间收集的细胞在200 × g离心2 - 10分钟。
洗涤(高速离心):对于病毒和亚细胞颗粒太小,无法通过上述低速离心成球,生物材料可以通过摆动斗转子或角头转子的高速离心从涂层二氧化硅颗粒中分离出来。从第一次离心运行中获得的未稀释馏分放置在离心管中,在摆动斗转子中以100,000×g旋转2小时,或在角头转子(100,000×g)中旋转90分钟,以使Percoll成球。生物材料保持在Percoll的硬颗粒之上[4,5]。
参考文献
[1] The viability of cells grown or centrifuged in a new density gradient medium, Percoll. Pertoft, H., Rubin, K., Kjellén, L. et al., Exp. Cell Res. 110, 449–457 (1977).
[2] Separation of human monocytes on density gradients of Percoll. Pertoft, H., Johnsson, A., Wärmegård, B. et al., J. Immunol. Methods 33, 221–230 (1980).
[3] Isopycnic separation of cells and cell organelles by centrifugation in modified colloidal silica gradients. Pertoft, H. and Laurent, T.C. In Methods of Cell Separation Vol. 1. (Catsimpoolas, N., Ed.) Plenum Press, New York 25–65 (1977).
[4] Separation of chloroplasts from mitochondria utilising silica sol gradient centrifugation. Jackson, C., Dench, J.E., Halliwell, B. et al., Presented at The Wolffson Conference, University of Surrey (July 1978).
[5] Isolation, characterization and cultivation of human trophoblastic cells. Calaminus, J.M., Brüggen, J. and Sorg, C. Immunobiol. 156, 287 (1979).
其他细胞品类
别划走,精彩继续

长按识别
添加一对一专属技术支持

扫码进群
咨询详细产品信息

点在看,传递你的品味















