【Lonza】人前体脂肪细胞(HPA)产品使用攻略
人前体脂肪细胞培养不成功、实验做不出来怎么办?新手小白迫切求助,希望各位前辈在文章下方留言,分享自己的经验,为小白们答疑解惑!
人前体脂肪细胞
(HPA)
脂肪细胞在能量储存和代谢中起着重要作用。脂肪细胞分化是一个对代谢稳态和营养信号传导至关重要的发育过程,受到基因表达和信号转导等复杂作用的调控。脂肪组织中的前脂肪细胞在成年期始终存在,并且可增殖和分化为成熟的脂肪细胞,从而增加脂肪组织的质量。体外研究表明,不同组织来源的前脂肪细胞在脂质积累、脂肪生成转录因子表达和TNFα诱导的凋亡方面存在差异。脂肪细胞分化与众多生理和病理过程密切相关,包括脂肪代谢、肥胖、糖尿病、高脂血症和乳腺癌。HPA分离自内脏脂肪或皮下脂肪组织,其CD44和CD90免疫荧光染色呈阳性,且分化后脂质染色呈阳性。
培养方式
Preadipocyte Medium (PAM, Cat. #7211)用于体外培养HPA-v。Preadipocyte Differentiation Medium (PADM, Cat. #7221)用于将前体脂肪细胞体外分化为成熟的脂肪细胞,随后使用Adipocyte Medium (AdM, Cat. #7201)来维持分化后的成熟脂肪细胞。
HPA的培养
培养基:HPA用提供的Preadipocyte Growth Medium-2完全培养基(包含Basal Medium、10% FBS及其他补充剂)培养。
操作步骤:
1) Preadipocyte Growth Medium-2完全培养基的配制:将室温融化的FBS、L-glutamine和GA-1000补充剂用移液器上下轻柔混匀,并全部加入到Basal Medium中并混合均匀,4℃避光保存(4℃下可保存4周,禁止反复冻融)。
2) 将融化后的HPA消毒后,超净台中转移至预热的完全培养基中,并用培养基冲洗冷冻管,并将冲洗液加入细胞悬浮液中。在室温下以300×g离心10 min。去掉上清收集细胞沉淀(保留1 ml左右的上清,禁止完全吸除,防止细胞损失),将2或3 ml的完全培养基加入细胞沉淀中,轻柔重新悬浮细胞沉淀。将20 µl的细胞悬浮液稀释在20 µl的0.4%的台盼蓝中,进行细胞计数并确定细胞的存活率(应约为90%)。
3) 在T25培养瓶中加入4-5 ml预热的完全培养基,加入HPA,使其种植密度为9,000 cells/cm2。(HPA细胞呈现圆形,在4 h内,超过90%的细胞应会附着并开始变扁和延长。24-36 h后,细胞会附着、延长并呈梭形。当HPA开始分裂时,它们会变成圆形。在有丝分裂期间,细胞会松散附着,分裂完成后会再次变扁和延长。)
换液:培养开始后至少16小时内不要干扰培养。第二天更换培养基,之后每3-4天更换一次培养基,直到培养达到约70%的密度。
传代:当细胞密度达到70%时进行传代。(HPA培养的倍增时间约为36-48 h。HPA应在70%的汇合度时停止培养,不要让细胞达到完全接触,因为这会导致细胞停止生长,进而分化。此时,细胞可以被收获并用于实验,或进行细胞传代,但原代HPA传代不超过2代。)
1) 将T/E、DPBS、培养基提前置于室温平衡(不建议37℃加热)。
2) 弃除旧培养基,并用DPBS(或等效的无钙镁平衡盐溶液)清洗细胞后吸除,加入Trypsin-EDTA溶液覆盖细胞层(约25 µl/cm2)。在室温下孵育3 min,然后在显微镜下观察。如果细胞未有90%以上脱离,继续孵育并每 min观察一次(孵育细胞时间不要超过15 min)。一旦> 90%的细胞变圆并脱离(轻拍培养瓶或培养皿可以加速细胞脱离),将培养瓶竖立,加入预热的完全培养基至每个培养瓶(约0.2 ml/cm2)。用移液管在细胞层表面多次吸液,使溶液均匀分散,并将细胞悬液转移至离心管中。
3) 300 × g的速度,在室温下离心细胞10 min。去除上清液,获得细胞沉淀。加入1ml预热的完全培养基,重悬细胞沉淀,对细胞进行计数。
4) 如需立即进行实验,将HPA以100,000 cells/ml的密度在Preadipocyte Growth Medium-2中重新悬浮并加入到培养瓶或培养板中,置于细胞培养箱中(孵育约24 h,HPA达到完全接触)。
生长条件:在CO2浓度为5%,温度为37℃,相对湿度(RH)为95%的细胞培养箱中培养。
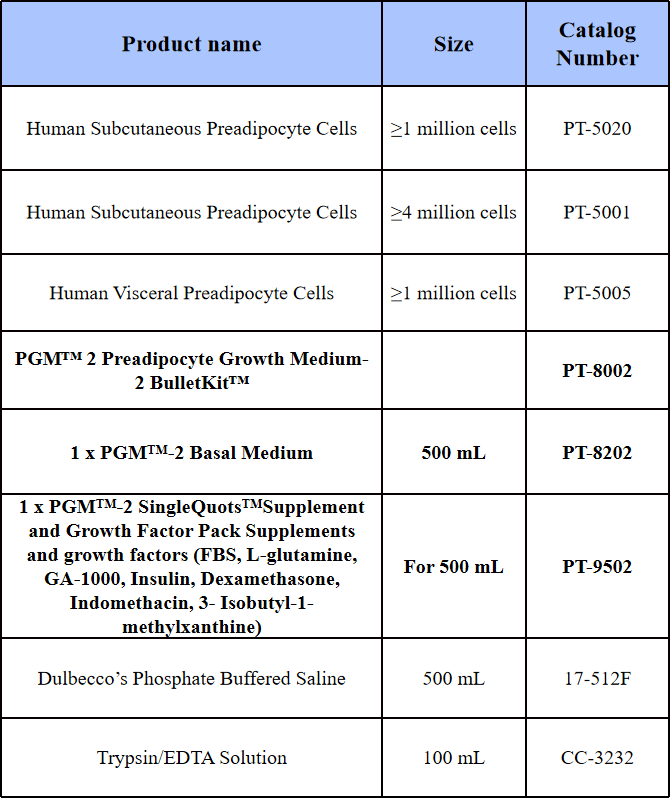
表1 HWP生长培养材料
参考文献
[1] Tominaga K, Johmura Y, Nishizuka M, Imagawa M. (2004) “Fad24, a mammalian homolog of Noc3p, is a positive regulator in adipocyte differentiation.” J Cell Sci. 117(Pt 25):6217-26.
[2] Reue K, Glueck SB. (2001) “Accumulating evidence for differences during preadipocyte development: Focus on differential gene expression in white and brown preadipocytes.” Physiol Genomics. 7(1):1-2.
[3] Tchkonia T, Tchoukalova YD, Giorgadze N, Pirtskhalava T, Karagiannides I, Forse RA, Koo A, Stevenson M, Chinnappan D, Cartwright A, Jensen MD, Kirkland JL. (2005) “Abundance of Two Human Preadipocyte Subtypes with Distinct Capacities for Replication, Adipogenesis, and Apoptosis Varies among Fat Depots.” Am J Physiol Endocrinol Metab.
其他细胞品类
别划走,精彩继续

长按识别
添加一对一专属技术支持

扫码进群
咨询详细产品信息

点在看,传递你的品味












