【ScienCell】人淋巴管内皮细胞(HLEC)产品使用攻略
人淋巴管内皮细胞培养不成功、实验做不出来怎么办?新手小白迫切求助,希望各位前辈在文章下方留言,分享自己的经验,为小白们答疑解惑!
人淋巴管内皮细胞
(HLEC)
淋巴系统是免疫系统的重要组成部分。它有助于维持组织内稳态,包括间质蛋白运输、组织液平衡和细胞免疫的发育。淋巴结分布在整个淋巴系统中,含有大量的淋巴细胞、巨噬细胞和抗原呈递细胞,共同启动初级免疫反应。
人淋巴管内皮细胞分离自淋巴管组织,是衬覆于淋巴管内表面的一种单层扁平上皮,构成淋巴管壁的主要结构,参与维持体液平衡,调节淋巴细胞再循环、机体的免疫反应和组织液及蛋白质的运输。皮质中的特化淋巴内皮细胞(LEC)通过吸引循环中的血管内淋巴细胞,协助进行初级免疫反应。此外,LEC负责促进血管内淋巴细胞的向网状网迁移,使淋巴细胞可以与抗原呈递细胞相互作用。近年研究表明,LEC在伤口愈合、淋巴管水肿和炎症扩散等病理过程中起重要作用,而且与肿瘤转移密切相关。
培养方式
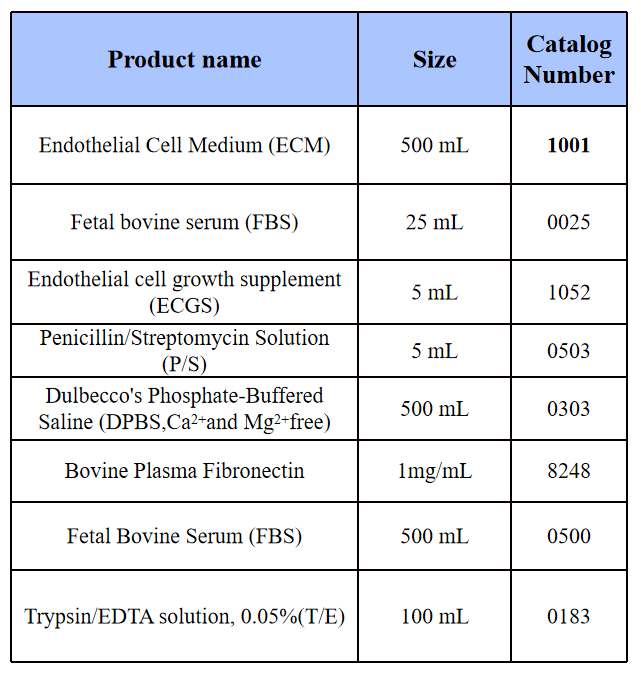
培养瓶:纤连蛋白(Bovine Plasma Fibronectin, 2 µg/cm2)包被培养瓶。
培养基:HLEC用提供的ECM完全培养基(包含基础培养基、5% FBS、1% ECG和1% P/S)培养。
操作步骤:
1) 包被纤连蛋白(2 µg/cm2)培养瓶的准备(T-75培养瓶):将5 mL无菌的Dulbecco's磷酸盐缓冲盐(DPBS)与150 µL纤连蛋白原液混匀后加入到T-75培养瓶中,将培养瓶放置在37°C的孵育箱中过夜(或至少2小时)。在铺细胞前将未凝固纤连蛋白溶液吸出(可重复使用2次),加入20 mL ECM完全培养基(基础培养基、FBS、FGS和P/S按比例混合配制)。
2) 将HLEC细胞量为5 x 105cells的冻存管放入37℃水浴中,待细胞融化后用75%酒精进行表面消毒后,转移至细胞操作台。小心地取下冻存管盖子(不要接触内螺纹)。轻轻地重新悬浮并将小瓶中的内容物放入37℃平衡、纤连蛋白包被的培养瓶中,十字交叉法轻柔平晃培养瓶,使细胞分散均匀。(注:不建议在解冻后对细胞进行稀释和离心,因为这些与培养物中残留DMSO的作用相比,这些作用对细胞的损伤更大;将HLEC置于纤连蛋白包被的培养瓶中,促进生长同样重要。)
换液:培养开始后16小时内不要干扰培养。次日更换培养液,去除残留的DMSO和未贴壁细胞。之后每三天更换一次培养基,直到培养达到大约70%的密度。一旦培养达到大约70%的密度,每隔一天更换一次培养基,直到培养达到大约90%的密度。
传代:当细胞密度达到90%时进行传代。
1) 将T/E、包被培养皿、DPBS、培养基提前置于室温平衡(不建议37℃加热)。
2) 弃除旧培养基,并用DPBS清洗细胞后吸除加入8 mL DPBS和2 mL 0.05% T/E solution 轻柔晃动培养瓶后放入37℃培养箱(注:原代细胞传代时请勿使用未稀释的胰蛋白酶),一段时间后镜下观察,待细胞完全变圆、脱落,轻轻拍打底部和侧面,加入1 mL FBS,将细胞悬液转移至15 mL离心管中,1000 rpm离心5 min,用新培养基重悬细胞沉淀后计数,根据5000-7000 cells/cm2的密度传代至预先用Bovine Plasma Fibronectin包被的培养皿中。
生长条件:在CO2浓度为5%,温度为37℃,相对湿度(RH)为95%的细胞培养箱中培养。
表 1 HLEC培养材料
参考文献
[1] Kaldjian EP, Gretz JE, Anderson AO, Shi Y, Shaw S. (2001) “Spatial and molecular organization of lymph node T cell cortex: a labyrinthine cavity bounded by an epithelium-like monolayer of fibroblastic reticular cells anchored to basement membrane-like extracellular matrix.” Int Immunol. 13: 1243-53.
[2] Willard-Mack CL. (2006) “Normal structure, function, and histology of lymph nodes.” Toxicol Pathol. 34: 409-24.
其他细胞品类
别划走,精彩继续

长按识别
添加一对一专属技术支持

扫码进群
咨询详细产品信息

点在看,传递你的品味












