【Serumwerk】细胞和组织中纯化:通过超声处理质膜部分(无洗涤剂)从细胞和组织中纯化小泡(Vesicle)
从细胞和组织中纯化小泡不成功、实验做不出来怎么办?新手小白迫切求助,希望各位前辈在文章下方留言,分享自己的经验,为小白们答疑解惑!
溶液制备
A. OptiPrep™
B. 稀释剂:0.25 M蔗糖,6 mM EDTA, 120 mM Tricine-NaOH, pH 7.6
C. 50%碘克沙醇(ρ = 1.282 g/ml)工作液:5体积溶液A与1体积溶液B混合
D. 悬浮培养基:0.25 M蔗糖,1 mM EDTA, 20 mM Tricine-NaOH, pH 7.6
试验方法
在0-4℃下执行所有操作。
1. 通过合适的技术制备质膜部分。
2. 将质膜悬浮于2 ml溶液D中,置于合适的管中(直径约1.5 cm)。
3.将管子放入冰中,并将超声探头的尖端(直径约3毫米)引入到距悬浮液顶部和底部等距的一点。
4. 以50J /W / s的总功率进行两次超声波,持续6秒,然后休息2分钟,再重复两次超声波,即总共6次超声波爆发。
5. 添加1.84 ml溶液C和0.16 ml溶液D。最终碘克沙醇浓度为23% (w/v)。
6. 分别用溶液D(1 + 4、2 + 3 v/v)稀释溶液C,制备10% (w/v)碘克沙醇(ρ = 1.076 g/ml)和20% (w/v)碘克沙醇(ρ= 1.125 g/ml)两种梯度溶液。
7. 使用标准的双腔梯度former或Gradient Master™在大约13ml的管中产生9 ml的10-20%的碘克沙醇梯度,用于摇摆桶转子。
8. 用4 ml样品覆盖梯度层,以53,000 gmax离心90 min。
9. 收集梯度的顶部5 ml,转移到新的离心管中,与4 ml溶液C混合。
10.用溶液D(分别为1 + 9 v/v和3 + 7 v/v)稀释溶液C,产生两种新的梯度溶液,分别为5%和15%碘克沙醇(w/v)
11.将1.0 ml 15%碘克沙醇和0.5 ml 5%碘克沙醇置于样品上,52,000 g离心90 min。
12.收集在15%碘克沙醇层上方形成的富含小窝的不透明层。
方法注释
均质介质和梯度溶液
蛋白酶抑制剂(PMSF,白细胞肽素,抗疼痛药,抑肽酶等)可包括在溶液B和D中。
质膜的制备和释放
覆盖从培养细胞制备质膜的精确方法超出了本说明书的范围。在使用OptiPrep™应用说明书中描述的分离小囊的方案进行分离的绝大多数已发表的论文也引用了Percoll®梯度法用于质膜的初始分离,如Smart等所述。
然而,除非Percoll®的胶体二氧化硅颗粒有助于超声处理的成功和随后的梯度分离,否则没有明显的理由不应使用用于隔离质膜的其他方法。此外,还有一种有趣的隔离质膜的替代方法,即利用阳离子二氧化硅与完整细胞表面的结合,由Chaney和Jacobson首先描述,二氧化硅提高了质膜的密度,从而允许其简单的隔离。Kincer等人通过小鼠血管灌注阳离子二氧化硅,以分离股动脉内皮细胞的细胞质膜。然而,对于任何培养细胞的质膜的密度扰动,这种方法可以不那么精细地使用。
Schnitzer等人也用胶体二氧化硅法检测大鼠肺内皮细胞。小窝膜的大小和结构配置破坏了它们与胶体二氧化硅的结合能力,因此它们可以作为一种抗洗涤剂膜回收。随后,胶体二氧化硅可以通过提高介质的离子强度和分离出的非小窝富含脂质结构域来分离,也可以作为抗洗涤剂膜。
Song等人介绍了另一种使用洗涤剂的选择;MDCK细胞依次在Dounce匀浆机、Polytron匀浆机和超声匀浆中在500 mM碳酸钠中匀浆,然后通过蔗糖梯度浮选获得富含小窝蛋白的膜。对于血管平滑肌细胞,Ishizaka等采用了相同的策略,但忽略了Polytron匀浆;使用相同的Dounce均质化/超声处理策略破坏HEK细胞。
在没有超声处理或去污剂的情况下,也可从肝癌细胞中分离出富含小窝蛋白的低密度膜。在常规匀浆培养基(137 mM NaCl, 50 mM Hepes, pH 7.4,含钒酸盐)中进行初始匀浆,通过27G注射器针头传代20次后,将核后上清液加载到2%,10%,15%和18% (w/v)碘克沙醇梯度上,并在23.5万g离心90分钟。在2%/10%碘克沙醇界面处条带富含小囊蛋白的结构域。Yanase和Madaio使用了类似的策略,同样用于肝癌细胞,但从梯度中省略了2%碘克沙醇。
碘二醇梯度制备
需要使用梯度体积,以便管是适当填充(根据制造商的说明)时,4毫升样品是下层。Smart等使用约9 ml的梯度。该方法可以根据需要放大或缩小,按比例调整样本体积和梯度。如果梯度的体积增加,含有小窝的部分所占的体积也可能增加。作为一个近似,上三分之一到一半的梯度应该被删除。如果梯度和样品的相对体积存在显著差异,可以通过电印迹法测定小窝蛋白的组分来检查小窝的分布。
收集连续的梯度
很可能只要简单地用附在扁头金属套管(内径约0.8毫米)上的注射器或自动移液器(其尖端已被切割以扩大孔)收集梯度的顶部5毫升就足够了。无论哪种方式,梯度必须非常缓慢地收回,以避免吸入较密集区域。为了获得更完整的分析结果,可以选择通过导管穿刺、用致密介质向上移位或从半月板抽吸来收集梯度。
不连续梯度
在第二个梯度中使用的体积可能也必须修改为更大的体积管;按比例增加样品和两层碘克沙醇的体积可能是一种好做法。用与扁头金属套管(内径约0.8毫米)相连的注射器或自动移液器收集界面带,其尖端已被切割以扩大孔。
相关产品推荐
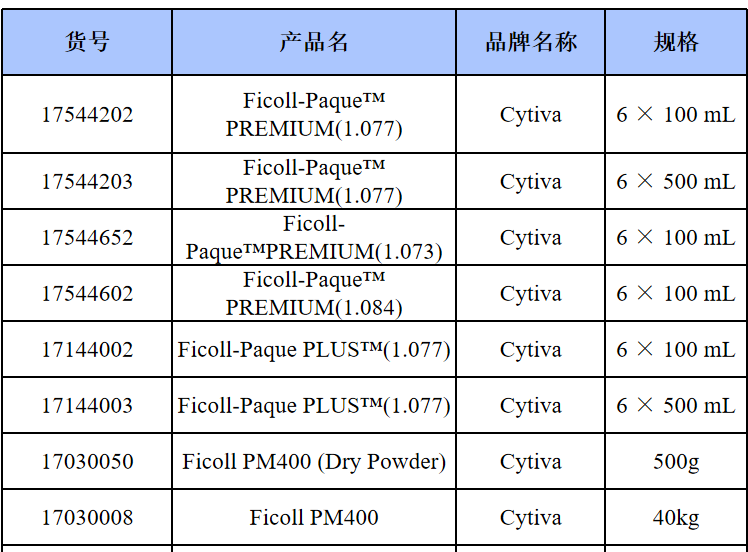
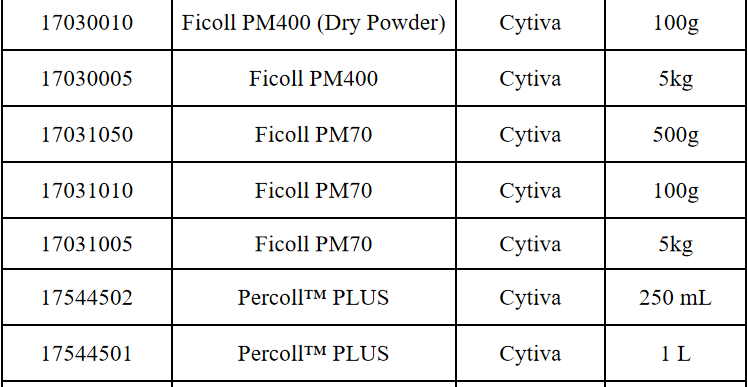
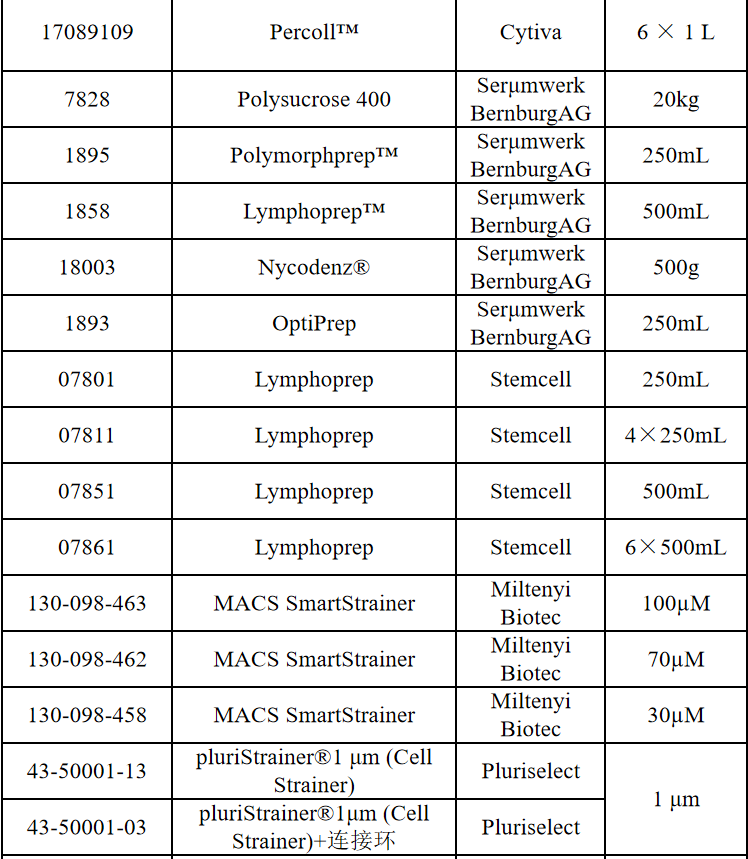

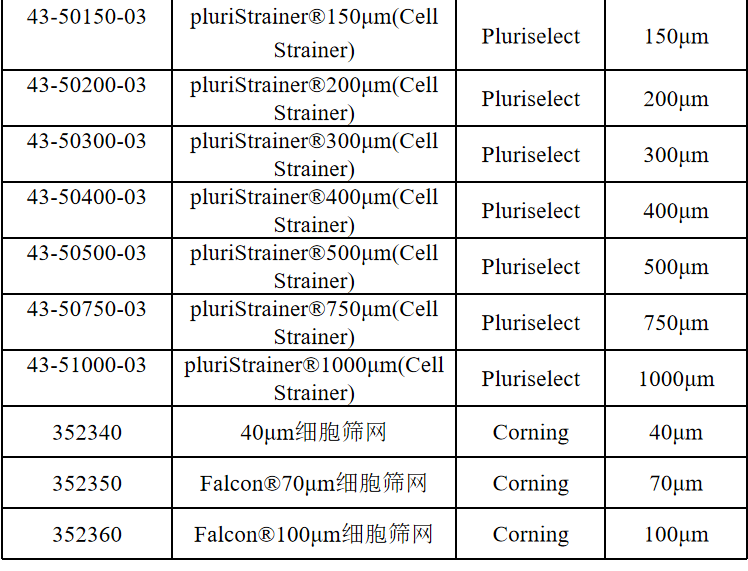
其他细胞品类
别划走,精彩继续

长按识别
添加一对一专属技术支持

扫码进群
咨询详细产品信息

点在看,传递你的品味












