【Serumwerk】溶酶体(lysosome)分离——不连续梯度
溶酶体分离不成功、实验做不出来怎么办?新手小白迫切求助,希望各位前辈在文章下方留言,分享自己的经验,为小白们答疑解惑!
溶液制备
A. OptiPrep™
B. 均质培养基:0.25 M蔗糖,1 mM EDTA, 20 mM HEPES-NaOH, pH 7.4
C. OptiPrep™稀释剂:0.25 M蔗糖,2 mM EDTA, 40 mM HEPES-NaOH, pH 7.4
D. 30% (w/v)碘克沙醇工作液:将等体积的溶液A和C混合,根据需要在溶液B和D中加入蛋白酶抑制剂。
轻线粒体部分制备
1.以800-1000 g离心10分钟,将细胞核、细胞碎片和任何未破碎的细胞制成颗粒。
2.将上清液滗出或抽吸,放在冰上保存。
3.将松散的Dounce匀浆机的舂杵轻轻敲击2-3下,将颗粒重新悬浮在溶液B中。颗粒的重悬必须在最温和的条件下进行,以避免损坏脆弱的细胞器。
4.重复离心并合并上清液。
5.将合并的上清液在3000 g下离心10 min,使重线粒体成球。吸出上清液,放在冰上保存。
6.在溶液B中重新悬浮颗粒并重复3000 g离心
7.将两份3000 g上清液合并,17 ~ 20000 g离心10分钟,产生轻的线粒体颗粒。
8.将轻的线粒体颗粒重新悬浮于溶液B中,重复17 ~ 20000 g离心。这个颗粒用于梯度输入。
在这部分过程中使用了多种离心条件。在某些情况下,轻线粒体部分被用于梯度输入,它可以在描述的模式中制备。用于产生梯度输入的方案有很大的变化。可省略第一个800 g步骤或3000 g步骤。有时将整个3000 g上清液应用于梯度或使用整个800-1000 g(核后)上清液(PNS),在更罕见的例子中使用整个匀浆。
使用PNS的优点是加速了梯度前的过程,细胞器不太可能因为重复的离心和再悬浮步骤而丢失,另一方面,所有与膜结合的细胞器和囊泡(细胞核除外)的存在将严重考验梯度的分辨能力。
不连续梯度离心法
注意,在一些已发表的方法中,梯度以% (w/v)碘克沙醇描述,有时以% (v/v) OptiPrep™描述;两种约定给出了相当不同的密度:20% (w/v)碘克沙醇是1.127 g/ml(使用0.25 M蔗糖稀释剂),20% (v/v) OptiPrep™相当于12% (w/v)碘克沙醇和1.088 g/ml的密度。
最常用的不连续梯度格式是10%、12%、14%、16%、18% (w/v)碘克沙醇(各等量),用溶液B稀释溶液D制备。将粗溶酶体部分调整为9% (w/v)并在梯度上分层。SW41的管可以容纳2 ml每种密度梯度溶液和样品。对于较小体积的转子,所有体积应按比例缩小。梯度通常在145,000 g离心2小时。溶酶体带靠近梯度的顶部。该方法已用于以下细胞类型:髓系细胞,神经母细胞瘤,肾皮质细胞,胰腺癌细胞,人肺癌细胞。
其它不连续梯度已用于分离组织或细胞PNS。
1.使用4、10、16和24% (w/v)碘克沙醇梯度,将样品加载于匀浆培养基的顶部,用于HeLa细胞和3T3成纤维细胞。在这个例子中,梯度在20000 g的浓度下离心17小时,在此期间它们肯定会成为连续的。
2.小鼠囊胚匀浆在6、9、12、15、18% (w/v)碘克沙醇梯度上分离,在100,000 g离心16 h。
3.采用12、14、16、18、20% (w/v)碘克沙醇梯度分离HeLa细胞溶酶体,150000 g离心5 h
4.在12.8、16、19、22.5、27% (w/v)碘克沙醇梯度中,将淋巴细胞轻线粒体组分中位数装载在19%碘克沙醇层,离心浓度为150,000 g,持续5 h。中间负载的优点是溶酶体将漂浮到它们的条带密度,而大多数较密的细胞器将沉积。溶酶体、线粒体和致密膜结合颗粒的分辨率很好。
5.肾皮质溶酶体已从调整为15% (w/v)碘克沙醇的PNS中纯化,加载到17、20、23、27和30% (w/v)碘克沙醇(145,000 g 2 h);细胞器在15- 17%碘克沙醇界面条带。同样的梯度和离心条件已用于HeLa细胞。淋巴细胞溶酶体的纯化使用轻微改变的梯度17、23、25、27、29和30% (w/v)碘克沙醇。乳腺PNS,微血管内皮细胞,Caco-2细胞和脑采用大致相似的不连续梯度。在所有这些梯度中,溶酶体会朝向梯度的顶部。
6.Khundadze等人设计了一种更为复杂的脑材料系统。基本上,首先在不连续的蔗糖梯度上将重的线粒体上清液分割成重的和轻的膜部分;然后通过25、23、21和19% (w/v)碘克沙醇梯度浮选(110,000 g离心2 h)从重馏分中富集溶酶体。
相关产品推荐
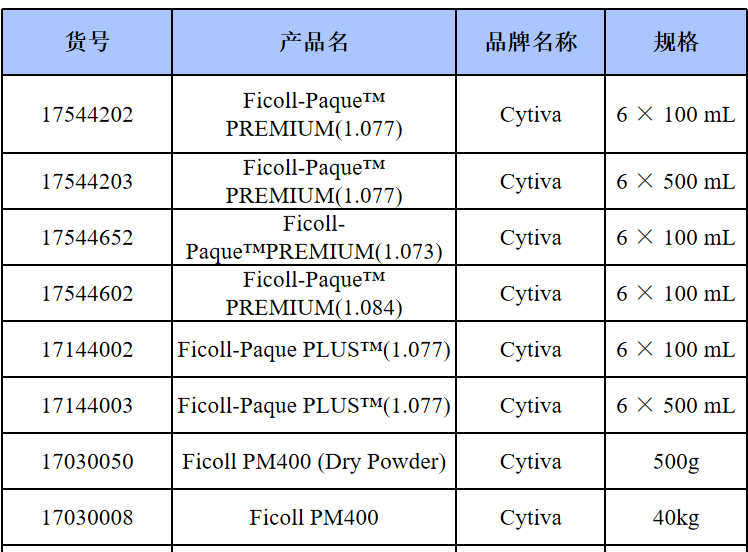
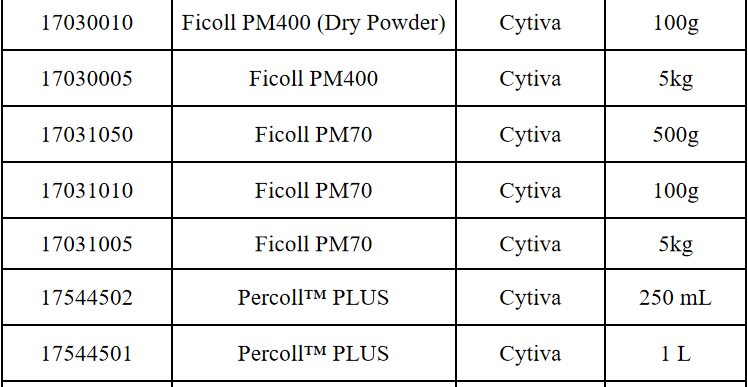
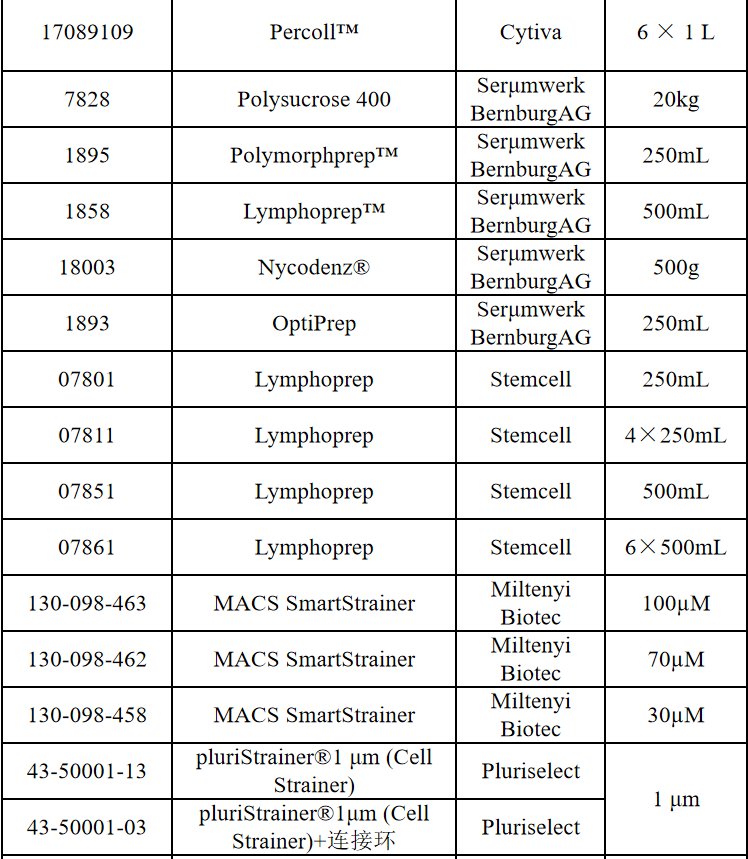
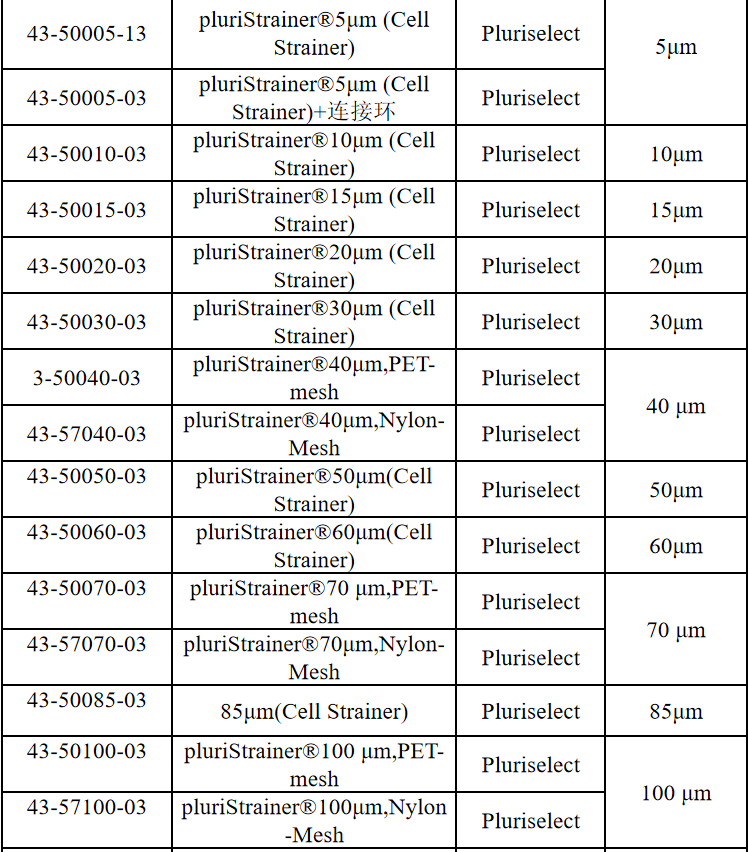
其他细胞品类
别划走,精彩继续

长按识别
添加一对一专属技术支持

扫码进群
咨询详细产品信息

点在看,传递你的品味












