【Serumwerk】神经相关细胞(Nerve associated cells)分离
神经相关细胞分离不成功、实验做不出来怎么办?新手小白迫切求助,希望各位前辈在文章下方留言,分享自己的经验,为小白们答疑解惑!
脊髓损伤组织相关细胞(Cells associated with spinal cord injury tissue)分离
碘克沙醇梯度对创伤性脊髓损伤后炎症反应的研究也有一定的帮助。通过采用4.5%、6%、7.5%和10.5% (w/v)碘克沙醇(OptiPrep™最初用0.15 M NaCl、10 mM MOPS、pH 7.4稀释为30%碘克沙醇,然后用Hank’s平衡盐溶液进一步稀释)四步不连续梯度将分离的脊髓细胞分层,并以1900 rpm离心15分钟,碎片残留在顶部界面,神经元带状分布在三个下方界面,炎症细胞和胶质细胞颗粒化。只有OptiPrep™梯度允许对脊髓损伤组织中PMN的存在进行正确的定量评估。
脑运动神经元(Brain motoneurons)分离
溶液制备
A. OptiPrep™(使用前轻轻摇瓶)
B. OptiPrep™ 稀释剂,如0.85%氯化钠,10 mM MOPS-NaOH,pH 7.4
C. 工作溶液(30%,w/v)碘二醇:混合等量的溶液A和B
D.悬浮介质(SM)
试验方法
1. 通过酶解和研磨从组织中制备单细胞悬液。
2. 将细胞悬浮在所选择的培养基中,这通常是Hibernate A,可以根据需要进行补充。配制密度为1.057、1.043、1.036、1.029 g/ml的梯度溶液:溶液C与溶液D的体积比为0.33:0.67、0.23:0.77、0.18:0.82、0.13:0.87。
3. 在15 ml离心管中分层各1 ml的4种密度溶液,然后将6 ml的细胞悬液置于顶部。
4. 在室温下以1900 rpm离心15 min。在减速时关闭刹车。
5. 从底部收集分离的细胞
用1-2体积的溶液D稀释,离心收集细胞。
方法注释
1. OptiPrep™稀释剂的选择可能随操作要求而变化。Brewer 观察到生理盐水(0.8-0.9% NaCl)用10 mM MOPS-NaOH缓冲,pH值7.4给出了更好的结果。然而,该稀释剂可为任何缓冲等渗溶液,例如,Hibernate A。
2. 溶液D通常是Hibernate A,但可以是任何适合与神经元兼容的介质。例如Hank’s平衡盐溶液;L-15培养基。
3. 四层之最佳密度可能需要一些实验。特别是对于来自其他物种的神经元,可能需要调节层的密度。精确密度应根据经验进行调整。
4. 如果存在某些较致密污染物,则可考虑纳入较致密层(例如1.07 g/ml)。是否可以通过将样品装入低于梯度的致密溶液中来提高分辨率是一个可以考虑的操作变体。
5. 一旦带状材料的区域和颗粒的组成得到验证,就应该制定出最佳的收获程序。
相关产品推荐
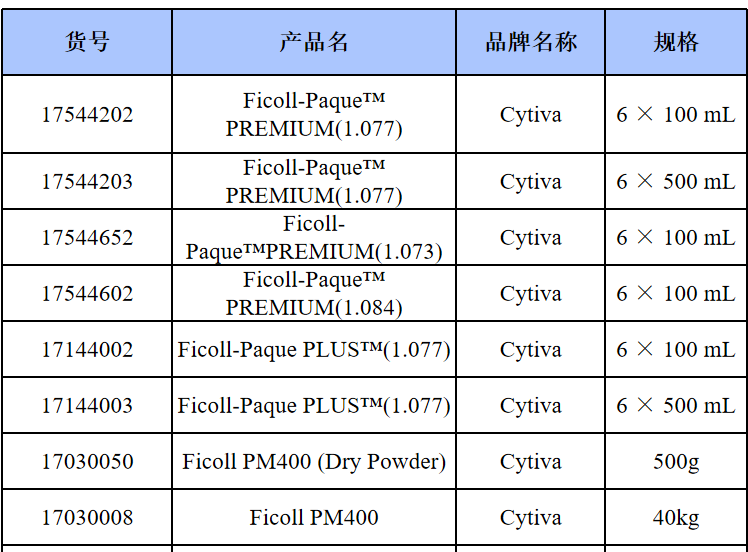
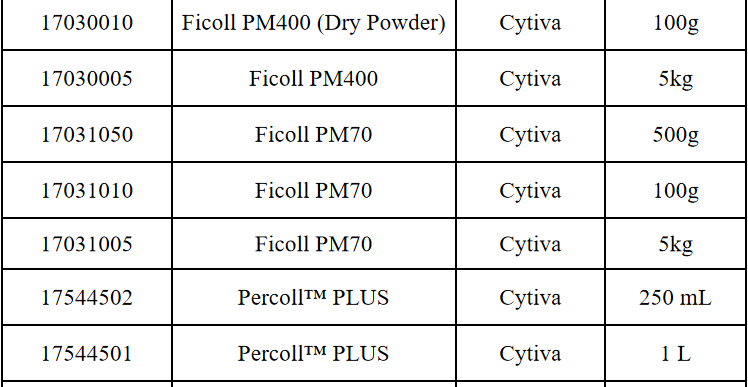
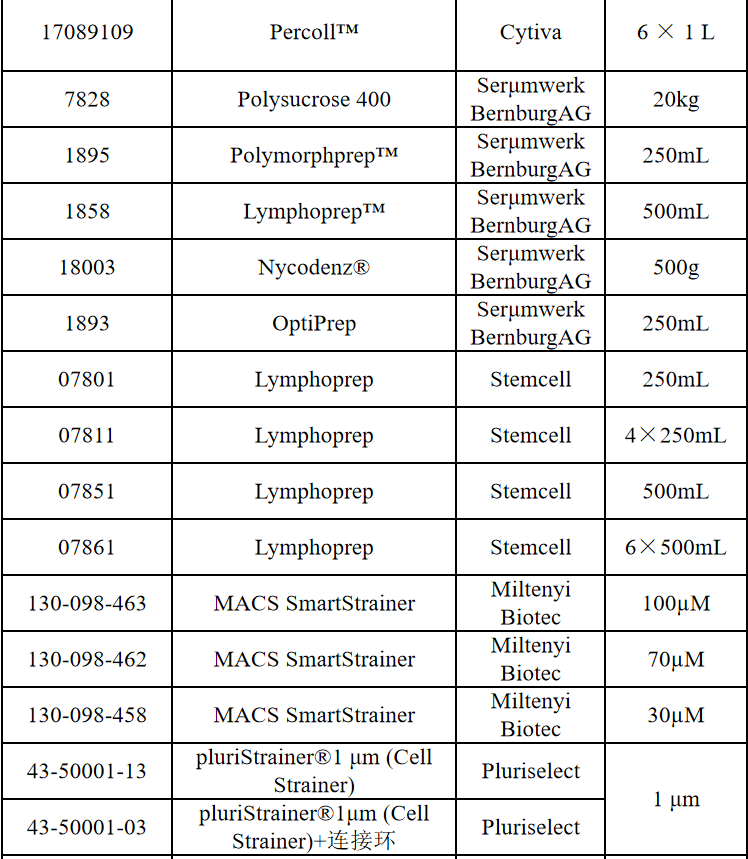
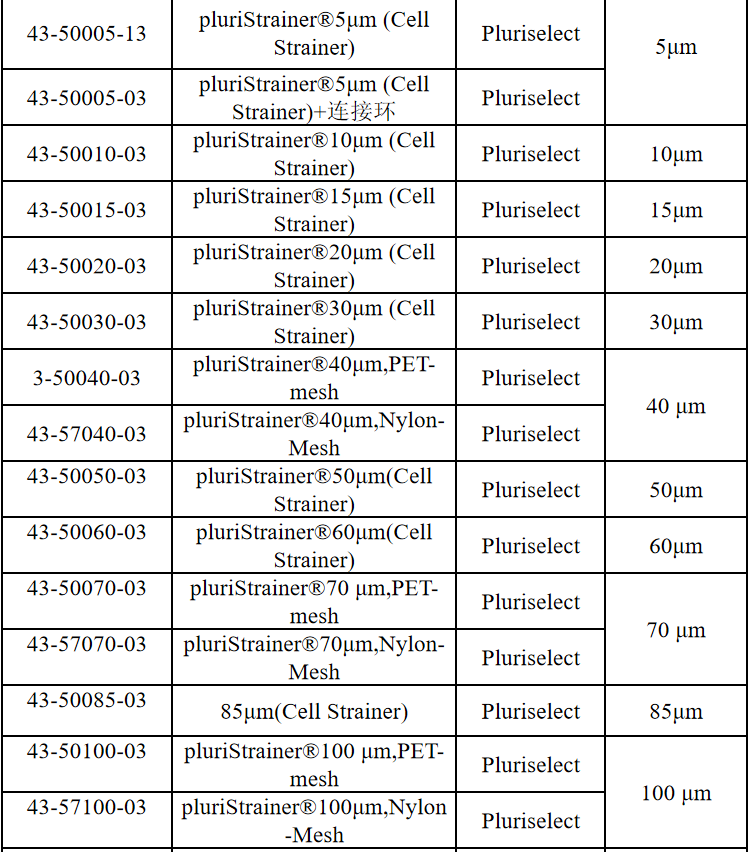

其他细胞品类
别划走,精彩继续

长按识别
添加一对一专属技术支持

扫码进群
咨询详细产品信息

点在看,传递你的品味












