【Serumwerk】极化上皮细胞自生成梯度的质膜结构域和顶端连接复合体分析
极化上皮细胞自生成梯度的质膜结构域和顶端连接复合体分析不成功、实验做不出来怎么办?新手小白迫切求助,希望各位前辈在文章下方留言,分享自己的经验,为小白们答疑解惑!
溶液制备
A. OptiPrep™
B. 均质培养基(HM): 0.25 M蔗糖,90 mM KOAc, 2 mM Mg(OAc)₂,20 mM Hepes KOH, pH 8.0
C. 稀释剂:540 mM KOAc, 12 mM Mg(OAc)₂,120 mM Hepes-KOH, pH 8.0
D. 工作溶液(50%碘克沙醇):5体积溶液A与1体积溶液C混合。
试验方法
在0°C下执行所有操作。所有碘克沙醇浓度以% (w/v)表示。
1.用溶液B洗涤细胞单层两次并将细胞刮入相同溶液中。
2.将细胞在600 g下颗粒化10 min,并将其重悬于1-3 ml溶液B中。
3.在细胞裂解器(滚珠匀浆器)中使用4-10次匀浆,或先用22G的针将悬液通过,然后用26G的针通过(每个针通过6次)。通过相差显微镜监测均质化的效果。
4.将匀浆3000 g离心10分钟,使密度较大的线粒体、细胞核和细胞碎片颗粒化。
5.抽吸3000 g上清液,将其与溶液D混合,调整为30% (w/v)碘克沙醇,体积比为2:3。
6.配制10%,20% (w/v)碘克沙醇溶液,将溶液D与溶液B混合,体积比分别为1:4和2:3。
7.将3.75 ml的三种碘克沙醇溶液通过分层或分层的方式转移到Optiseal™管(11.2 ml)中,用于垂直或接近垂直的转子。
8.以35.3万gav的速度用缓慢加速程序离心3小时。
9.允许离心机在没有刹车的情况下从2000转减速到休息或使用缓慢减速程序。
10.通过置管、向上移位或从半月板抽吸的方法收集梯度,每0.5 ml收集1次。
方法注释
均质化介质
均质化培养基(HM)通常必须针对组织或细胞类型进行定制,并且不知道HM的组成是否与分离相关。介绍了有机渗透平衡剂如蔗糖、甘露醇和山梨醇在亚细胞膜功能研究中的相容性;此外,这些低离子强度的HMs和梯度溶液允许直接使用馏分进行SDS-PAGE。用无机盐(含K+或Na+离子)补充HM变得越来越常见,可以减少离子相互作用,膜之间的聚集,并对抗任何由于细胞骨架蛋白引起的匀浆粘度的提高。一些不含蔗糖的培养基完全使用氯化钠或氯化钾或两者作为主要的渗透平衡剂。HM的组成也应与任何后续分析过程兼容。二价阳离子的加入可以防止核破裂;一般稳定膜,但可能导致聚集。Yeaman 对NRK-49F和NRK-52E大鼠肾细胞也使用0.25 M蔗糖,90 mM KOAc, 2 mM Mg(OAc)2, 20 mM Hepes-KOH, pH 8.0。用Tris, Hepes, Tricine或三乙醇胺(10-20 mM浓度)缓冲溶液,如果缓冲液的类型显著影响分馏,则不太可能,尽管三乙醇胺似乎在均质化效率方面提供了一些优势。如所述的工作溶液的制备,确保KOAc, Mg(OAc)₂和缓冲液的浓度在整个梯度是恒定的,而蔗糖和碘克沙醇作为渗透平衡器,以保持一个大约恒定的渗透浓度。如果认为这一点不重要,则可仅通过使用溶液B稀释OptiPrep™来制备碘克沙醇溶液。在某些情况下,表面蛋白在均质化之前由二硫双(琥珀酰亚胺本体酸)交联。可根据操作者的判断将蛋白酶抑制剂包括在溶液B和C中。
均质化
Dounce(有时是Potter-Elvehjem)均质化曾经是最广泛使用的程序,但滚珠轴承均质器或“细胞裂解器”,与标准的0.3747 in (9.52 mm)滚珠轴承,现在被认为是最有效和可复制的设备之一。如果这是不可用的,但是通过注射器针头的10-20通道(压力表编号(G)从21到26不等)通常是一个有效的替代方案。有时,如本研究方案中所示,通过在一半的注射过程中更换另一根更细的注射器针头,可以提高该方法的疗效。偶尔使用注射器针头前会先进行Dounce匀浆。理想情况下,操作应尽可能温和和可重复,目的是造成至少95%的细胞破坏,而不破坏主要细胞器,特别是细胞核和溶酶体。均质化过程的类型和严重程度将对细胞器的完整性和细胞质中由管状结构产生的囊泡的大小产生影响。因此,膜带在任何后续梯度中的模式可能不容易预测。
差速离心
核的移除
可在500-3000g下进行5-10 min的核造粒;更高的RCFs (g力)导致一些线粒体的去除。为了回收被困在颗粒中的任何囊泡(在RCFs较高的情况下更严重),有时将颗粒重新悬浮在HM中,离心,并将两种上清液结合在一起。这种做法的一个可能的缺点是,除非颗粒的重悬非常温和,否则细胞核可能被破坏,从而导致DNA的泄漏,这可能导致亚细胞膜几乎不可逆的聚集。
梯度加载样品的制备
如果3000g上清液的大小大得不方便,那么微粒体可能需要在100,000g的浓度下造粒45分钟,并在总体积为1.5 ml的溶液B中重悬,然后调整为30% (w/v)碘克沙醇。请注意,在100,000g上清液中,大多数细胞质蛋白将被去除。Yeaman还建议使用由10%、15%、20%、25%和30% (w/v)碘克沙醇组成的替代梯度,在这种情况下,需要将3000g上清液或重悬微粒体调整为35% (w/v)碘克沙醇。这种格式能更好地从漂浮的致密膜中分解非常缓慢沉积的低MWt蛋白。10%和20%碘克沙醇层也可通过将3000g上清液与溶液D混合来制备;这使得每个梯度的样品载量更大,但较小的可溶性蛋白的膜区室的分辨可能不太清楚。
设置梯度
虽然使用注射器和金属套管分层是制作不连续梯度的推荐方法,但叠加可能更方便,因为管子需要完全填充到颈部底部。
分析
使用e -钙黏蛋白作为基底外侧标记物和gp135作为顶端标记物,梯度明显非常有效地解决了这些结构域。MDCK细胞中E-cadherin和gp135主要条带的分离率最高可达0.1 g/ml。与钙黏蛋白共结合的Na+/K+ ATP酶。值得注意的是,来自上皮样NRK-52E细胞的主要Ecadherin条带的密度远低于来自MDCK细胞的密度,这强调了当使用这些梯度来分离不同类型细胞的膜室时,可能会发现质膜密度的差异。每种细胞类型可能有其独特的膜带模式。Vogelmann和Nelson发现Occludin通过梯度广泛分布,但它最主要集中在梯度的基底外侧域区域,而claudin主要在顶端域区域。JAM-A和crumb3局限于梯度较密集的区域。然而,如果收获梯度最密集的区域;稀释至10% (w/v)碘克沙醇;制成第二个10%、20%、30%碘克沙醇梯度的一部分,并在相同的条件下重新离心,JAM-A现在出现在梯度的中间,可以从更密集的带状碎屑中完全溶解。这可能表明,JAM-A和碎屑都存在于比基底外侧域或顶端域更致密的颗粒中,但含有JAM-A的颗粒要小得多。Vogelmann和Nelson利用梯度,结合免疫荧光显微镜,重新评估MDCK细胞表面多种蛋白的分布,并研究上皮顶端连接复合体在表面极性发展中的时间作用。Yeaman比较了contact-naïve和极化MDCK细胞中Sec6/8复合体的易位和定位,而Amieva等人使用梯度系统从MDCK细胞中分离出包含细胞间连接,顶端和基底外侧结构域和细胞质的部分,在他们的研究中,来自幽门螺杆菌的CagA蛋白破坏上皮细胞顶端连接复合体。在Gromley等人关于MDCK细胞中Exocyst和SNARE复合物的中心Olin锚定的研究中,中心Olin主要与膜相关,并且与密度略低于连接相关峰的Sec8共同分离。在这些梯度中,基底外侧和顶端结构域与高尔基体的清晰分离表明了微管偶联对极化细胞中高尔基体后运输的重要性。Wang等人在研究E- cadherin运输时将离心时间延长至4小时。
通过将3000 g上清液混合到三个碘克沙醇层,Yeaman等研究了在诱导MDCK细胞Ca2+依赖性细胞黏附过程中Occludin和Sec8的重新分布。自身产生的碘克沙醇梯度也被用于研究Par复合体蛋白与MDCK细胞紧密连接的关系,以及识别来自基底外侧膜周围培养基的包含咬合蛋白的小泡。
新方法
Gerl等使用了一种新的方法,从生长在可渗透支架上的MDCK细胞中捕获自由漂浮的顶端膜。将其覆盖于半干滤纸(Whatman 3-MM) 10 min,然后在150 mM碳酸氢铵中复水30 min,并用细胞刮板刮除表面。将含有膜和滤纸残余物的上清液用纯OptiPrep™覆盖,并在13 ml试管(例如Beckman SW 41Ti)中以160,000 g离心3 h。去除上清液的大部分,留下1 ml,在界面处条带的膜收集在剩余的1 ml和2 ml OptiPrep™(最终碘克沙醇浓度为40% (w/v)碘克沙醇)中,并覆盖30%的碳酸氢铵碘克沙醇,然后再覆盖碳酸氢铵。在280,000 g离心90分钟后,从30%碘克沙醇/碳酸氢铵界面收获膜。
其他质膜结构域
Bandyopadhyay能够从在含brij的溶液中匀浆的HepG2细胞中,在2.5%,10%,20%,30%碘克沙醇梯度(125,000 g处理12小时)中分离出轻质和致密的质膜结构域。光结构域富集于Thy-1 (gpi锚定蛋白),而Lyn和甘油醛磷酸脱氢酶位于致密结构域。
相关产品推荐
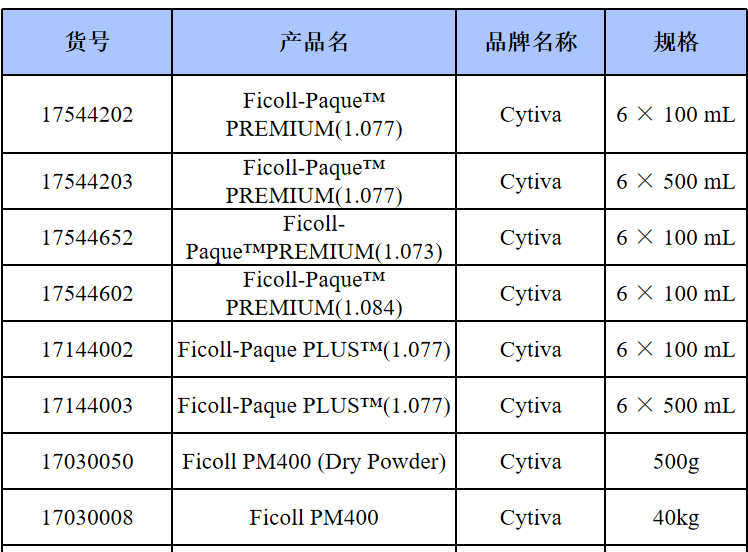
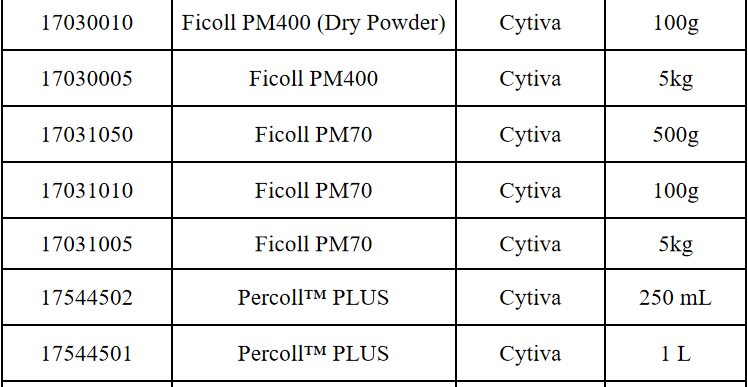
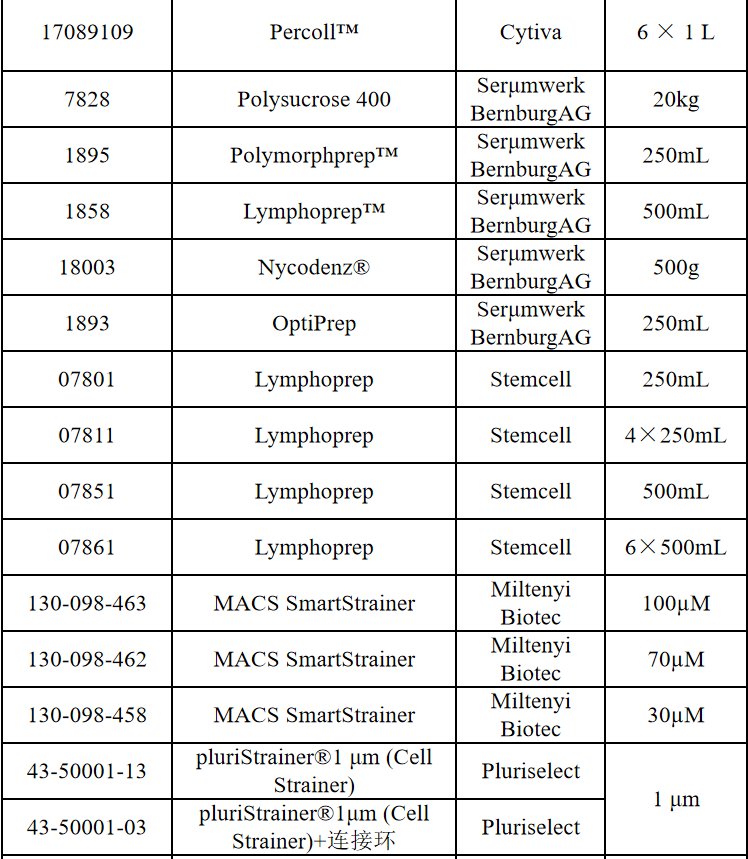
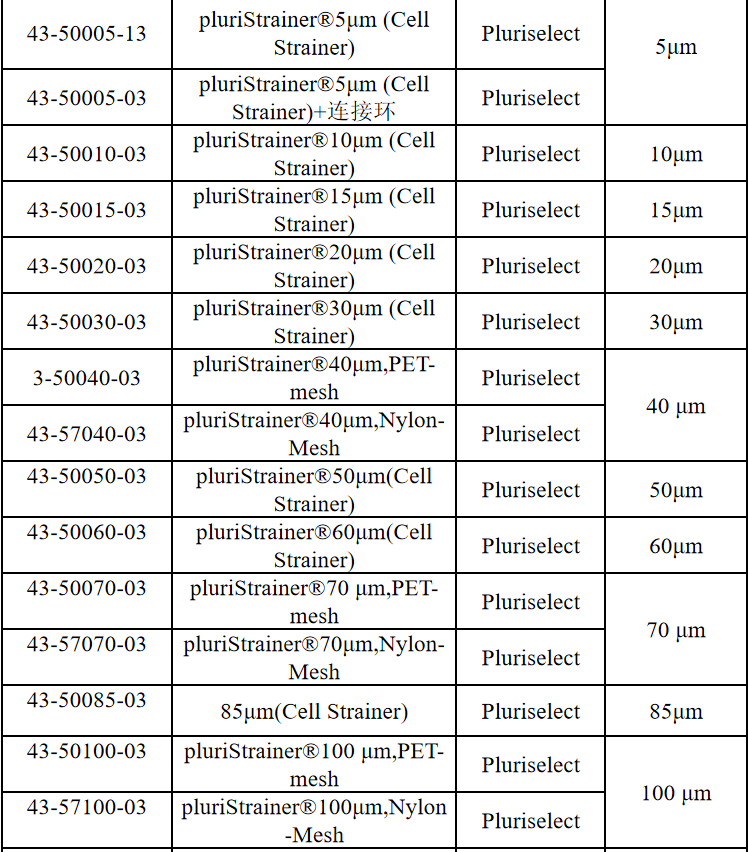
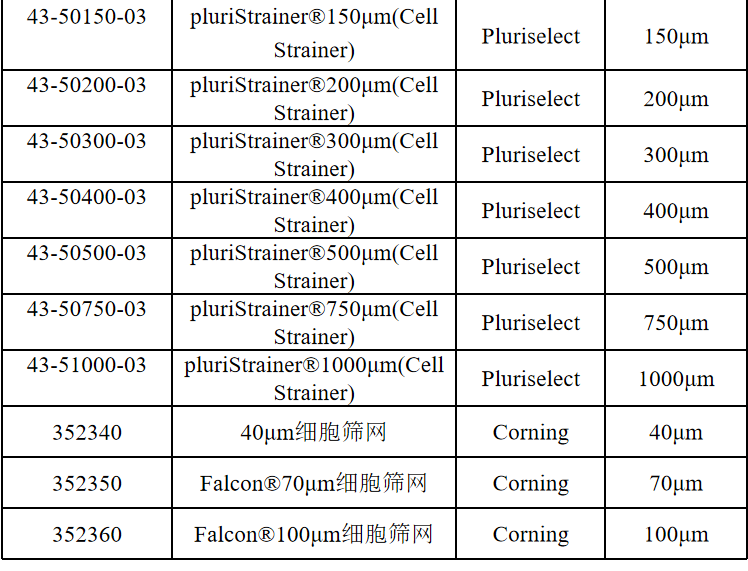
其他细胞品类
别划走,精彩继续

长按识别
添加一对一专属技术支持

扫码进群
咨询详细产品信息

点在看,传递你的品味












