【Serumwerk】利用阳离子胶体二氧化硅分离质膜和质膜结构域
利用阳离子胶体二氧化硅分离质膜和质膜结构域不成功、实验做不出来怎么办?新手小白迫切求助,希望各位前辈在文章下方留言,分享自己的经验,为小白们答疑解惑!
溶液制备
A. Hank’s平衡盐溶液(HBSS)
B. 涂层缓冲液:135 mM NaCl, 1 mM MgCl₂,0.5 mM CaCl₂,20 mM MES-NaOH, pH 5.5
C. 用溶液B稀释到1% (w/v)的阳离子二氧化硅胶体
D. 聚丙烯酸:溶液B中加入1 mg/ml,用NaOH调节pH至5.0
E. 裂解缓冲液:(LB): 1 mM MgCl₂,0.5 mM CaCl₂,2.5 mM咪唑- hcl, pH 7.0
用胶体二氧化硅处理细胞单分子层
分离细胞的涂层和均质化
除步骤1外,所有操作均应在0 ~ 4℃环境下进行。
1.使用EDTA和/或胰蛋白酶或胶原酶的常规处理将细胞从基质中分离并在溶液A中洗涤细胞两次。
2.在溶液B中洗涤细胞三次。
3.将细胞(例如50 μl包装细胞体积)悬浮于0.2 ml溶液B中。
4.将1.25 ml稀释的阳离子二氧化硅胶体(溶液C)与细胞悬液快速混合。
5.混合后立即用稀约。将8体积的溶液B以700 g离心5 min以使细胞成球。
6.抽吸并丢弃胶体二氧化硅上清液。
7.将细胞悬浮在原体积的溶液B中,与5体积的溶液D混合。
8.混合后立即用约8体积的溶液B稀释并以700 g将悬浮液离心5分钟以使细胞成球。
9.将细胞颗粒悬浮于溶液E中,静置30分钟。
10.使用Dounce匀浆器将细胞匀浆。
11.以900 g将匀浆离心10 min。
12.将颗粒重新悬浮在2ml溶液E中,在较低的设置下超声处理1秒。
单层细胞的涂覆和溶解
除步骤1外,其他操作均在0 ~ 4℃环境下进行。
1.在溶液A中洗涤单层两次。
2.在溶液B中洗涤单层两次。
3.用溶液C覆盖细胞,然后用溶液B清洗单层细胞。
4.用溶液D覆盖细胞,用溶液B洗涤单层2次。
5.用小体积的溶液E迅速清洗单层,并抽吸,确保所有残留的溶液B被清除。
6.将2-3 ml溶液E倒入单层上并在冰上静置约30分钟以裂解细胞并使用光学显微镜监测裂解。
7.如有必要,可从连接短而窄的金属套管(约18G)的注射器中反复排出溶液E,协助溶解,但注意不要导致细胞脱落。
8.当约90%的细胞溶解后,抽吸并保留悬浮液,其中包含顶端的PM结构域和从溶解的细胞中释放的细胞器。
9.用溶液E仔细清洗残留材料(基底外侧PM),并将洗涤液添加到原始抽吸物中。可将残余材料溶解以通过SDS-PAGE和Western blotting进行分析。
10.以900 g将抽吸物离心(加洗涤)10 min。
11.将颗粒重新悬浮在2ml的溶液E中,在较低的设置下超声处理1秒。
总PM或顶端PM域的梯度纯化
通过将3 ml OptiPrep™or各1 ml 5%、43% (w/v)碘克沙醇和未稀释的OptiPrep™分层,将总PM或顶端PM域从超声试剂中分离出来。用溶液E分别稀释OptiPrep™1:11和43:17 v/v,制备两种低密度溶液。在4℃下30,000 g离心30分钟,并将PM或顶部PM颗粒重新悬浮于合适的溶液中用于分析。
方法注释
涂层和均质化溶液
用阳离子二氧化硅和聚丙烯酸薄膜覆盖细胞的溶液都用MES缓冲,呈微酸性(pH值5-5.5),但在其他方面的组成有很大的变化。通常将相同溶液用于最初悬浮细胞和两种涂覆试剂的媒剂。Chaney和Jacobson使用140 mM山梨醇,20 mM MES, pH 5.0的Dictyostelium,而对于小鼠胚胎成纤维细胞,Cain等使用含有280 mM山梨醇,150 mM NaCl, 20 mM MES的高渗缓冲液。然而,用于CHO细胞和牛主动脉内皮细胞的缓冲液更类似于常规缓冲盐水(补充低水平的二价阳离子)和大约等渗。涂布液的渗透压和成分对涂布过程有什么影响尚不清楚。过量的二氧化硅胶体是必要的,在Chaney和Jacobson发表的原始方法中,涂层过程中使用的阳离子二氧化硅胶体的浓度(3- 4% w/v,最终浓度)高于后来研究中更广泛使用的约1% (w/v)。然而,在早期的研究中,使用了数量更大的非哺乳动物(Dictyostelium)细胞。阳离子二氧化硅胶体可以根据Chaney和Jacobson的方法制备,也可以从Sigma-Aldrich或EKA Chemicals购买。也使用较低浓度的聚丙烯酸(约0.2 mg/ml) ;虽然通常与二氧化硅胶体在同一涂层溶液中,但对于Dictyostelium,聚丙烯酸被溶解在70 mM NaCl, 20 mM MES-NaOH, pH 6.5中。裂解缓冲液可为将允许有效破坏涂覆矽膜之细胞之任何适宜缓冲液。可根据操作者的判断将蛋白酶抑制剂包括在溶液E中。
制备覆盖层的细胞
对于更大数量的细胞,Chaney和Jacobson使用了不同的方法。将含有140 mM山梨醇、20 mM MES、pH 5.0(最终体积为4 ml)的盘基骨(2 ml包装细胞体积)缓慢添加到4 ml阳离子二氧化硅胶体(用缓冲山梨醇稀释至6-8%,w/v)中,同时非常轻柔地涡旋。可能需要针对不同类型和不同数量的细胞优化包被条件。
与聚丙烯酸反应
Chaney和Jacobson在涡流混合器上缓慢将细胞悬浮液添加到聚丙烯酸中。
包被细胞的均质化
均质化方案应根据细胞(或组织)类型量身定制。这种被膜可能使细胞不易被常规的液体剪切技术破坏,但使用低渗透裂解缓冲液似乎可以消除这些问题,随后Cain等能够在Dounce匀浆器中匀浆小鼠胚胎成纤维细胞。其他标准程序,如通过注射器针头(规格号(G)从21到25不等)12-20次,有时在此之前进行Dounce匀浆,或滚珠轴承匀浆器(“细胞裂解器”),可能适用,但哪一个是最有效的涂层细胞只能通过实验来确定。氮空化能最有效地匀浆包膜的Dictyostelium。理想情况下,操作应尽可能温和和可重复,目的是造成至少95%的细胞破坏,而不破坏主要细胞器,特别是细胞核和溶酶体。均质化过程的类型和严重程度将对细胞器的完整性和细胞质中由管状结构产生的囊泡的大小产生影响。
涂覆PM部分的再悬浮
使用配备微型探针的Branson Sonifier 185, Stolz和Jacobsen使用2设置。重要的是,任何涂层材料都是作为均匀的悬浮液应用于梯度。超声处理是推荐的程序,但由于被包裹的PM颗粒也将包含细胞核,这需要进行尽可能温和,否则任何DNA从细胞核释放可能导致严重的聚集。
覆膜PM组分的梯度离心法
对于被涂覆部分之隔离而言,尚不清楚连续梯度或不连续梯度与简单密度障壁格式相比是否具有任何实际优势。加速度范围20000 ~ 60000 g,离心时间20 ~ 45 min。
相关产品推荐
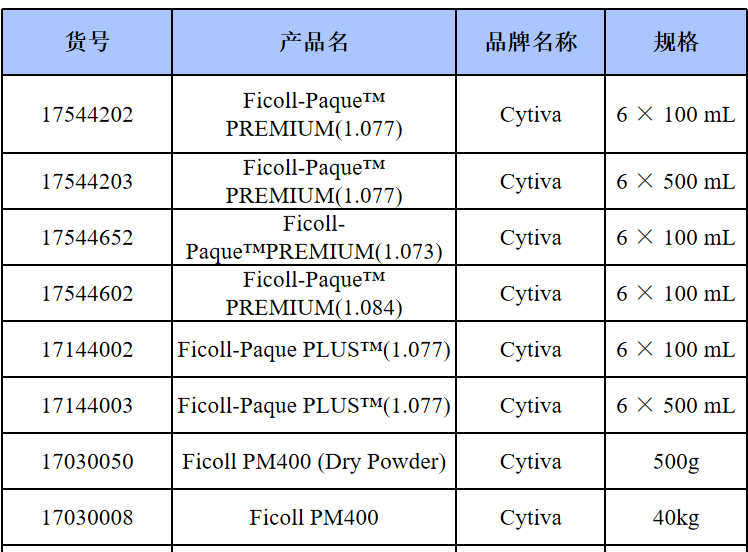
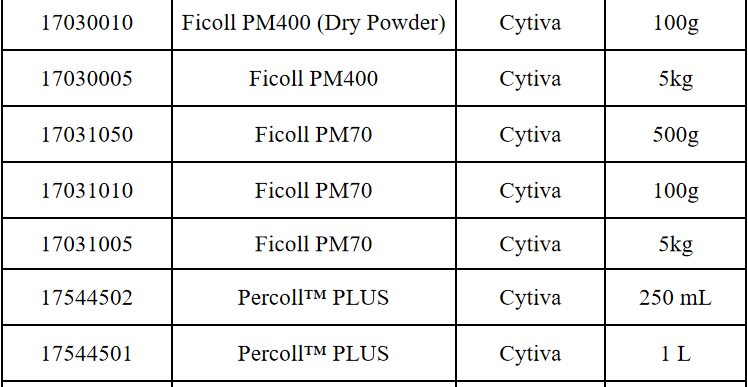
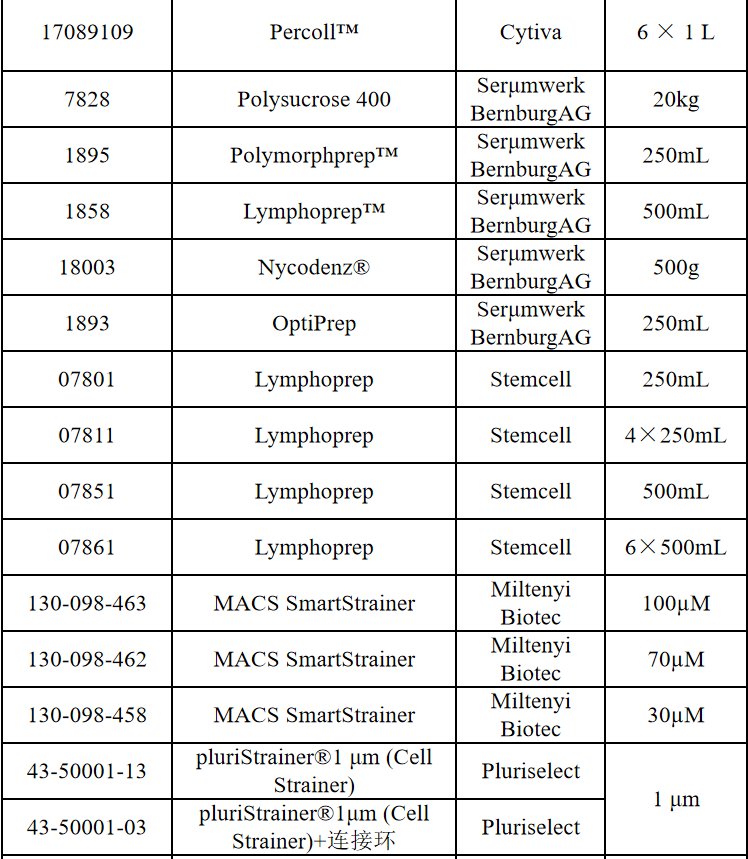
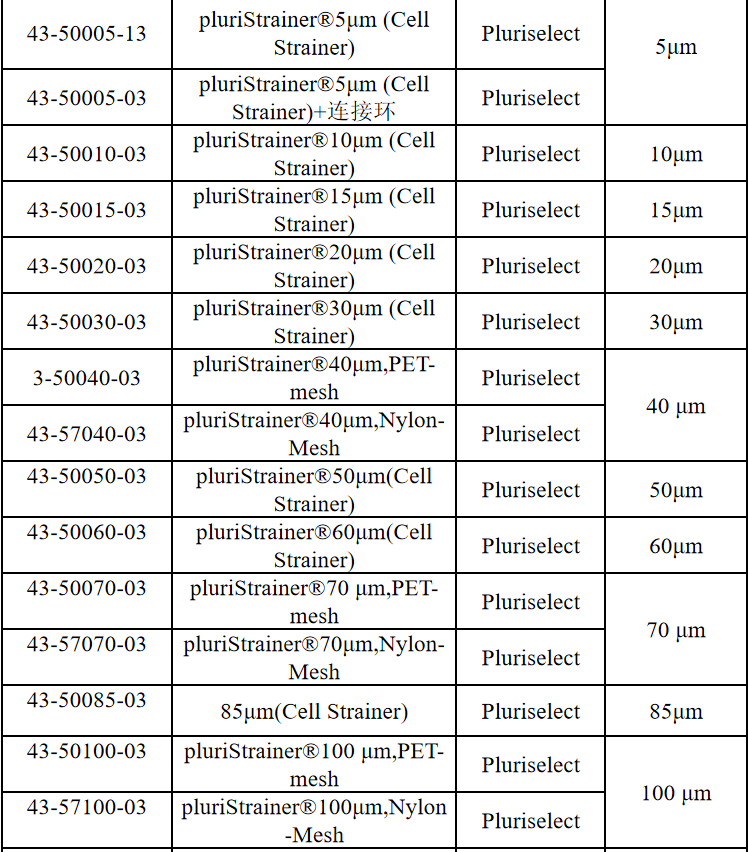
其他细胞品类
别划走,精彩继续

长按识别
添加一对一专属技术支持

扫码进群
咨询详细产品信息

点在看,传递你的品味












