【Serumwerk】内质网、质膜、核内体、高尔基体、ERGIC和TGN分离——自生成梯度
内质网、质膜、核内体、高尔基体、ERGIC和TGN分离不成功、实验做不出来怎么办?新手小白迫切求助,希望各位前辈在文章下方留言,分享自己的经验,为小白们答疑解惑!
溶液制备
A. OptiPrep™
B. 均质培养基:0.25 M蔗糖,10 mM Tris-HCl, pH 7.4
C. OptiPrep™稀释剂:0.25 M蔗糖,100 mM Tris-HCl, pH 7.4
D. 54%碘克沙醇工作液(ρ= 1.291 g/ml): 9体积溶液A与1体积溶液C混合
试验方法
在0-4℃下执行所有操作
微粒体制备
1. 制备组织或细胞的匀浆;在本方案中,组织(肝脏)在溶液B中使用Potter-Elevehjem匀浆器,用舂槌轻轻敲击5-6下进行匀浆。
2. 通过1000 g离心10分钟去除细胞核。
3.仔细滗出1000 g上清液,以15,000 gav离心20分钟,使线粒体、溶酶体、过氧化物酶体和高尔基体膜成球。
4. 使用注射器和金属套管仔细抽吸15,000 g上清液,以避免干扰有时松散的颗粒上部区域。
5. 以100,000 gav离心45分钟,将15,000 g上清中的微粒体制成颗粒,并将颗粒重新悬浮于溶液B中(每10g肝脏30 ml)。
微粒体分馏
1. 将6.3体积的微粒体悬浮液与3.7体积的溶液D混合(最终碘克沙醇浓度20%,w/v;ρ = 1.127 g/ml)。
2. 转移到管(11-14毫升)的垂直转子或近垂直转子。
3.离心机在350,000 gav 2小时,关闭制动期间从3000转减速。
4. 用密集溶液向上移位或通过管道穿刺获得0.5-1.0 ml的梯度,用于分析。
方法注释
1. 蛋白酶抑制剂(PMSF,白细胞肽素,抗疼痛药,抑肽酶等)可根据操作者的判断包含在任何或所有介质中。
2. 管道的沉降路径长度应该约为17毫米。例如,使用Beckman VTi65.2垂直转子,可以将制备物缩小到约5 ml的管。虽然Morand等人实际使用的离心时间仅超过2小时,但使用这种较小体积的转子应该可以将离心时间减少到约1小时45分钟。使用小体积高性能固定角度转子可能是可行的,但为了产生具有正确密度分布的梯度,需要调整离心条件。
3. 所选择的管是Optiseal管,这只适用于贝克曼转子。由于他们是密封的中央塑料加而不是热或卷曲密封,他们很容易使用,最重要的是,他们可以通过任何标准技术卸载的梯度,开放的顶部管摆动斗转子。
4. 溶液B可为任何缓冲等渗蔗糖溶液。另外,对于一些培养的细胞,可能需要在均质化前将其膨胀。例如,Call等使用10 mM Hepes-KOH, pH 7.5使浆细胞瘤细胞膨胀。一定要尽快将匀浆恢复到等渗状态。
5. 可省略1000 g步骤,但保留步骤2可提高产率。如果像步骤4那样直接处理匀浆,大量快速沉降的核和碎片可能会捕获许多其他更小的颗粒。
6. 用于去除轻线粒体颗粒细胞器的离心条件从10,000 g到17,000 g不等,从10-20分钟不等。
7. 微粒体的离心条件不同;Higashi等人使用138,000 g作用1 h。
8. 可以忽略100,000 g微粒体的沉降,只需取12,000 g上清液并将其调整为20%碘克沙醇。虽然这是快速的,它的缺点是细胞溶质蛋白污染梯度组分;然而,这些可以随后通过将膜颗粒化去除。
9. Higashi等人使用100000 g 13小时,虽然转子没有指定。Liao和Carpenter也使用小体积(1 ml/管)的过夜离心(200,000 g),但同样没有给予转子。
10. 密度分布图在梯度的顶部非常陡峭,对于溶解低密度区域的囊泡并不理想。为了更满意地研究这些囊泡,或者,例如,如果需要专门研究SER或RER,可以通过改变碘克沙醇的起始浓度或离心条件来改变梯度的密度分布。
相关产品推荐
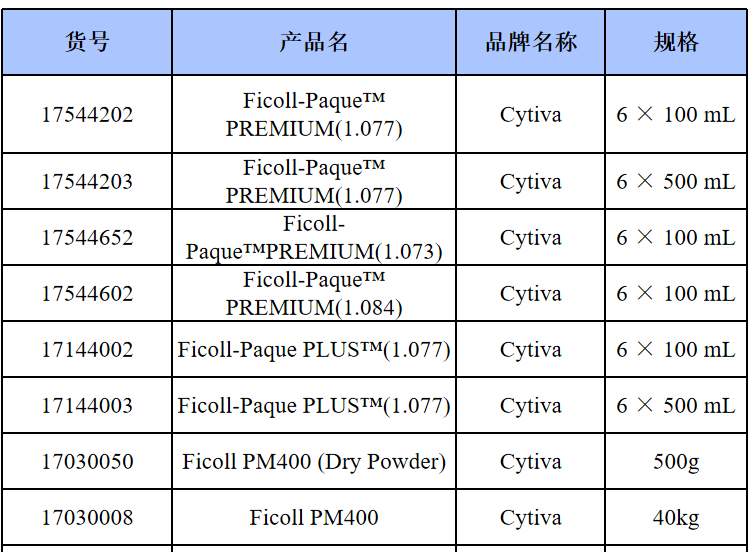
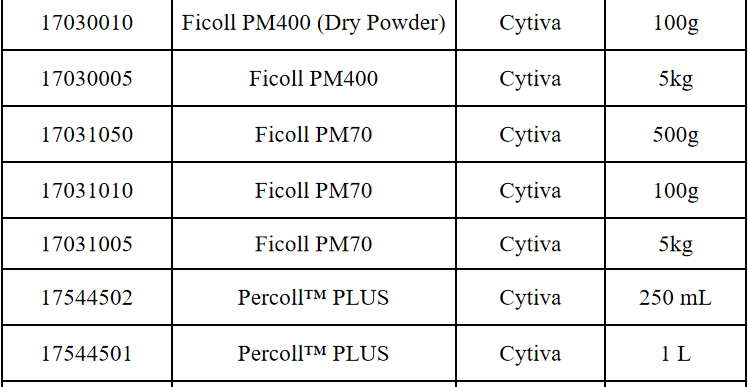
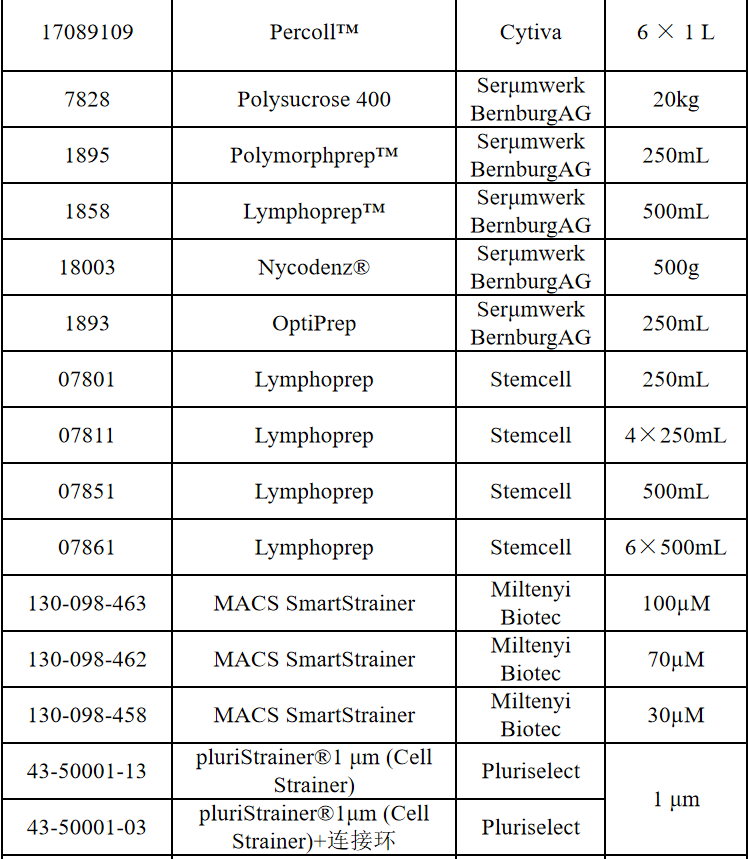
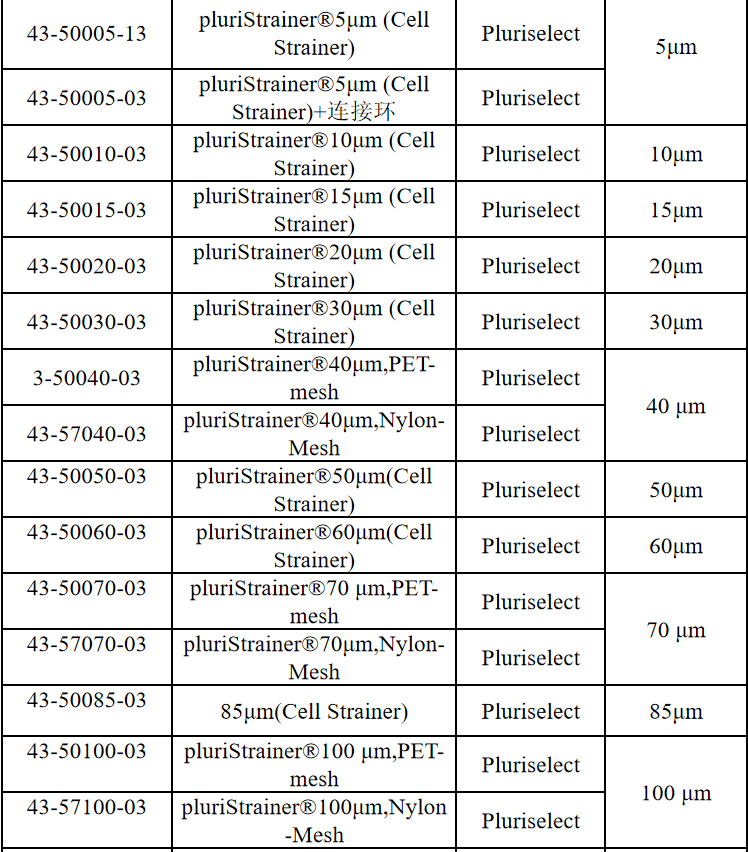
其他细胞品类
别划走,精彩继续

长按识别
添加一对一专属技术支持

扫码进群
咨询详细产品信息

点在看,传递你的品味












