human polymorphonuclear leukocytes
富白细胞血浆中分离人多形核白细胞不成功、实验做不出来怎么办?新手小白迫切求助,希望各位前辈在文章下方留言,分享自己的经验,为小白们答疑解惑!
溶液制备
A. OptiPrep™(使用前轻轻摇晃)。
B. 稀释剂:0.85%(w/v)氯化钠,1 mM EDTA,20 mM HEPES-NaOH,pH 7.4
C. 多蔗糖:6%(w/v)多蔗糖(Mr=400-5000x103),0.85%(w/v)氯化钠
D. 裂解缓冲液:0.83%(w/v)氯化铵,10 mM HEPES NaOH,pH 7.0
E. 1.8(w/v)氯化钠,20 mM Hepes-NaOH,pH 7.4
试验方法
1. 在9体积的新鲜血液(含2 mM EDTA作为抗凝剂)中加入1体积溶液C。
2. 使聚集的红细胞沉降到底部(室温下20-40 min);然后吸出全部上清液。
3. 从OptiPrep™和溶液B(分别)制备以下密度溶液:1.077 g/ml, 5体积+ 17体积和1.090 g/ml, 8体积+ 22体积;或者1.095 g/ml, 17体积+ 43体积。
4. 取2.5-3.0 ml 1.077 g/ml溶液,1.090 g/ml或1.095 g/ml相同体积的任一LRP溶液5 ml置于底层。
5. 在18-22℃下,以800 g离心25 min。
6. 从下界面获取PMN,从上界面获取单个核细胞。
7. 用等体积的B溶液稀释PMN悬液,250-350 g离心10 min收集PMN。
8. 将颗粒重悬于适合分析的培养基中。
9. 为了去除PMNs中残留的红细胞污染,将细胞颗粒重悬在3ml溶液D中,在37℃孵育7 min或将PMNs重悬在3ml冰蒸馏水中,30秒后加入等体积的溶液E。
10. 通过离心收集PMN并在合适的培养基中重悬。
方法注释
1.如果认为细胞暴露于多聚蔗糖是不可取的(有证据表明这种大分子可吸附到白细胞表面),则在18-22℃下以200g将血液离心15-20分钟,并从包装的红细胞顶部获得血浆上清液中的白膜并在步骤4中使用该白膜。
2.可将甲基纤维素添加到血液中作为用于红细胞聚集的多聚蔗糖的替代品。另一种去除红细胞的方法是将12% (w/v)的碘克沙醇在130 mM NaCl中分层,其中含有1.66%的甲基纤维素。静置1g后,将聚集的红细胞沉淀至管底。
3.当该垫层密度为1.090 g/ml时,少量中性粒细胞和大部分嗜酸性粒细胞将穿过该垫层。如果选择1.095 g/ml的密度,几乎所有的PMN都将被高密度屏障保留。另一方面,使用低密度垫层时,LRP中较少的残留红细胞会污染PMN带。
4.偶尔将1.077 g/ml低密度碘克沙醇层替换为常规商业外周血单个核(PBMC)分离培养基,如Lymphoprep™。可能有使用这种溶液作为其组分之一(5.7% (w/v)多聚蔗糖)的一些优点可能使残余红细胞进一步聚集,从而帮助其沉降成颗粒。另一方面,该多聚蔗糖浓度几乎是方案第2步血液中调整的浓度的10倍。
5.在最近对12名健康男性的研究中,两层碘克沙醇梯度恒定地给出了95%的产率。
表1总结了在报道使用本应用表中描述的方法从灵长类动物外周血中净化PMN的已发表论文中描述的一些梯度和离心条件。

该方法已被用于从牛、豚鼠、小鼠、兔和大鼠来源分离PMN,但略有变化。
相关产品推荐
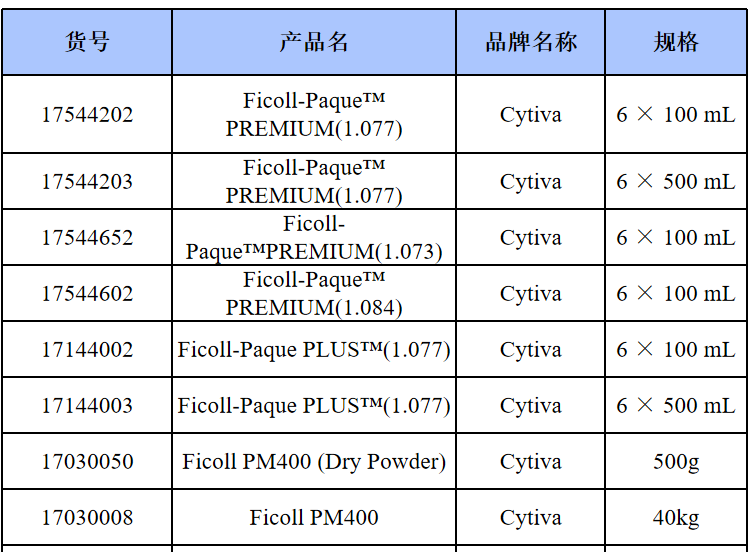
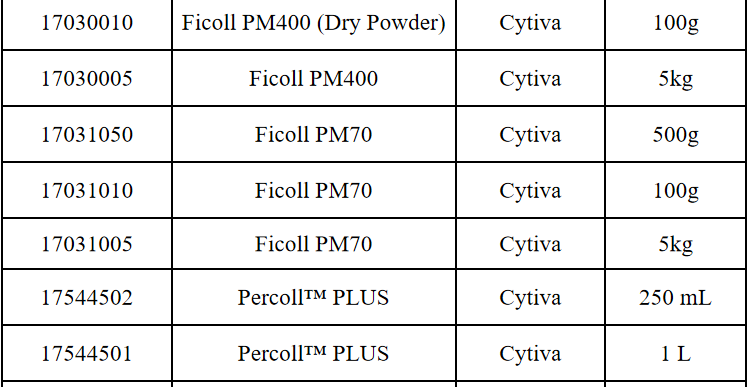

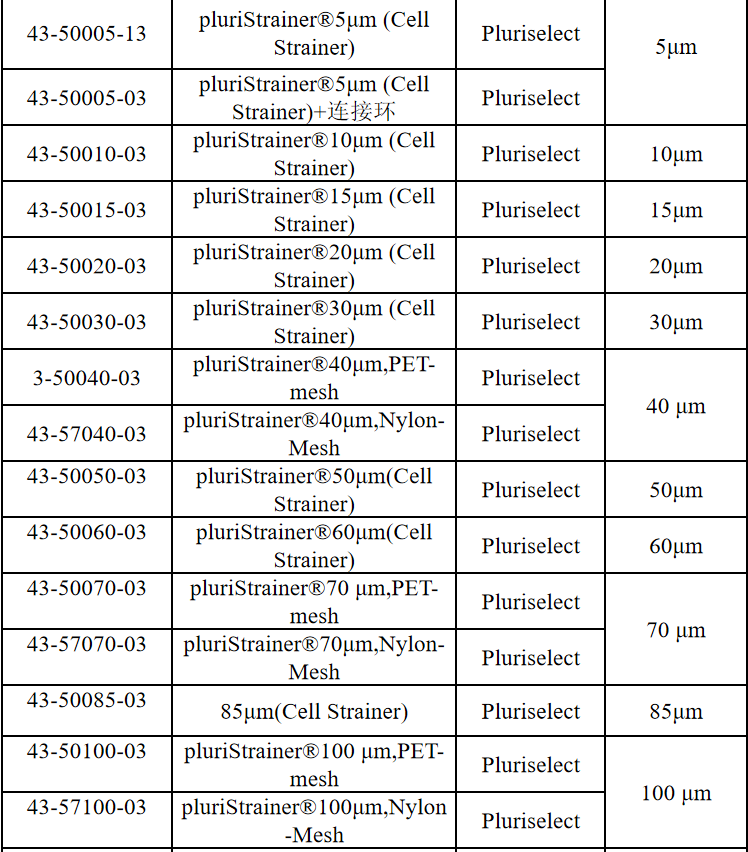
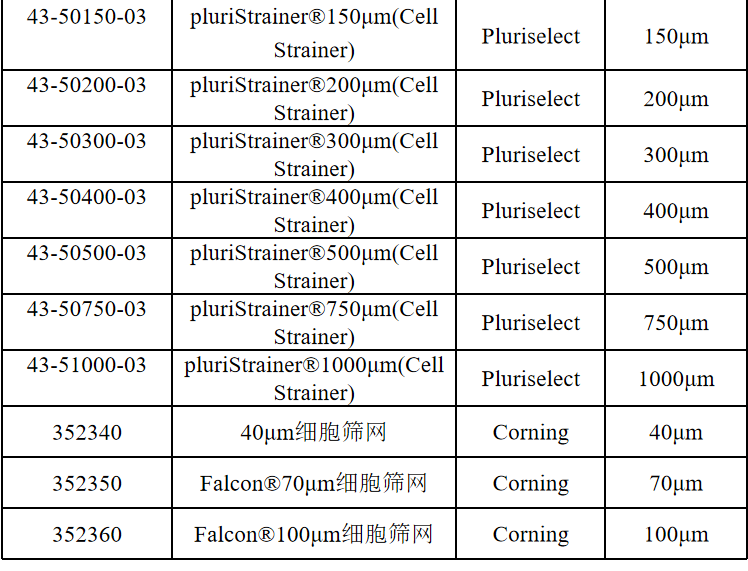
其他细胞品类
别划走,精彩继续

长按识别
添加一对一专属技术支持

扫码进群
咨询详细产品信息

点在看,传递你的品味












