【Serumwerk】来自非哺乳动物来源的细胞外囊泡(Extracellular vesicles)——梯度方法学
溶液制备
A.OptiPrep™
B.0.85% (w/v) NaCl, 60 mM HEPES(或Tricine) -NaOH, pH 7.4
C.0.85% (w/v) NaCl, 10 mM HEPES(或Tricine) -NaOH, pH 7.4
制备50% (w/v)碘克沙醇原液(ρ = 1.268 g/ml),将5体积的OptiPrep™与1体积的溶液B混合,然后使低密度溶液与溶液C稀释该原液。此确保缓冲液浓度和渗透压在整个梯度中或多或少保持恒定。如果认为不必要,则只需用溶液C稀释OptiPrep™。
Horstman和Kuehn将OMVs悬浮在50 mM HEPES- naoh pH 6.8缓冲液中(偶尔使用20 mM HEPES)。这种简单的缓冲液在pH为6.8到7.5时仍被广泛使用。然而它是低渗的。Kesty和Kuehn在同一缓冲液中以较低的浓度(0.85% w/v NaCl, 10 mM HEPES-NaOH, pH 6.8)加入NaCl。有时也使用常规磷酸盐缓冲盐水。
在将悬浮液调整为高密度之前,将囊泡悬浮液返回到含NaCl的等渗介质中可能是制备用于密度梯度的样品的最方便的方法
梯度制备
样品中最广泛使用的碘克沙醇浓度为45% (w/v)。偶尔使用较高的50% (w/v)或较低的40% (w/v)或35% (w/v)浓度。
无一例外,所有的梯度都是不连续的,层被沉积在致密的样品上。然而,那些被离心过夜(16-18小时)的梯度将变得或多或少的连续(但不一定是线性的),因为溶质从高浓度的溶液扩散到低浓度的溶液。如果梯度溶液是用与EV悬浮液相同的0.85% (w/v) NaCl缓冲溶液稀释OptiPrep™制备的,那么整个梯度将近似等渗。
虽然不连续的梯度层最常通过叠加执行(即从最密集的层开始),底层从最不密集的溶液开始通常更容易执行,使用注射器和宽口径(约0.8 mm内径)金属填充套管。
Horstman和Kuehn开发了一种多层梯度,其中样品(含45% w/v碘克沙醇)被35%、30%、25%、20%、15%和10% (w/v)碘克沙醇覆盖,在180,000 g离心3小时。不同层的体积比保持或多或少恒定(0.4:3:3:2:2:1:1);两个密度最小的层的体积有时会增加。Davis等人在所有层中使用1ml,其中最上层包括3ml缓冲液。Tashiro等使用每种的0.5 ml(并添加40% w/v碘克沙醇层)。随后同组除样品和10% (w/v)碘克沙醇层(0.5 ml)外,其余各使用1.0 ml。
由于碘克沙醇梯度中MV的密度一般为1.11 g/ml(许多条带介于1.13 ~ 1.15 g/ml);可以认为没有必要包括密度分别为1.085和1.058 g/ml的15%和10% (w/v)碘克沙醇层。因此Kesty和Kuehn引入50%、45%、40%、35%、30%和25% (w/v)碘克沙醇(各2 ml)的不连续梯度。
通过删除顶部的25% (w/v)碘克沙醇层,一些梯度的密度范围发生了偏移;在这些情况下,MV带在梯度的顶部或接近顶部聚集;分离类型类似于分离任何膜囊泡,使其远离更致密的颗粒和可溶性蛋白质。
更为简化的系统以50%、40%和10% (w/v)碘克沙醇的不连续梯度纯化了革兰+ve微生物金黄色葡萄球菌和枯草芽孢杆菌的MV。该梯度分离的MV密度为1.16 ~ 1.20 g/ml,分离出可溶性蛋白、蛋白质聚集物和变性MV。
离心条件
用于分离铜绿假单胞菌OMVs的梯度已针对不同来源的使用进行了定制:40%、35%、30%、25%和20% (w/v)碘克沙醇;对于囊性纤维化分离株,省略25%的溶液;此外,每个层的体积也被优化以分离可溶性蛋白和鞭毛。在10万g离心16小时后,OMVs的条带非常接近梯度的顶部。
真菌界(Fungi)
将真菌新生隐球菌培养的微血管悬于35% (w/v)碘克沙醇(3 ml)中,并分别覆盖3 ml 30%碘克沙醇和2 ml 25、20、15和10%碘克沙醇。在14万g离心仅15分钟后,MV在梯度的中间宽带状分布。
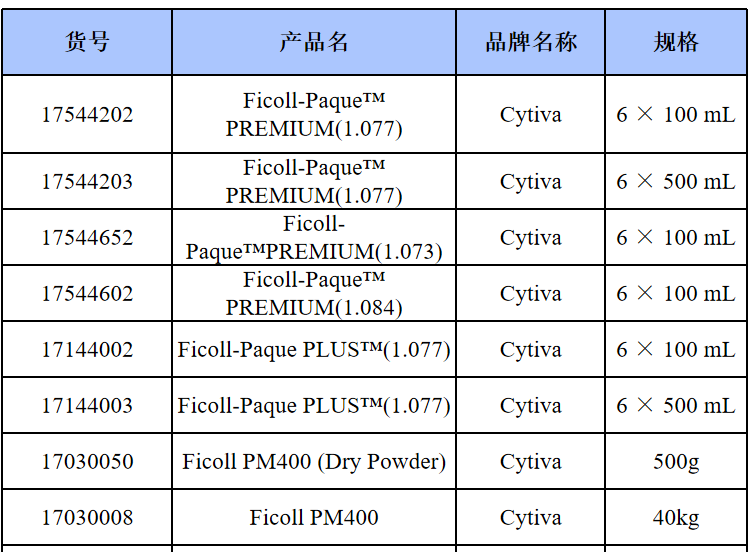
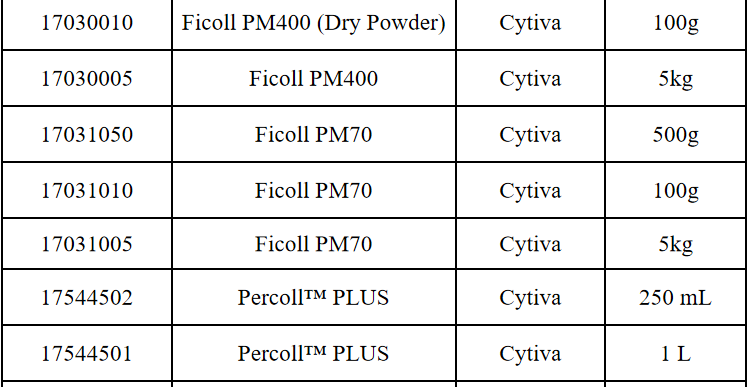
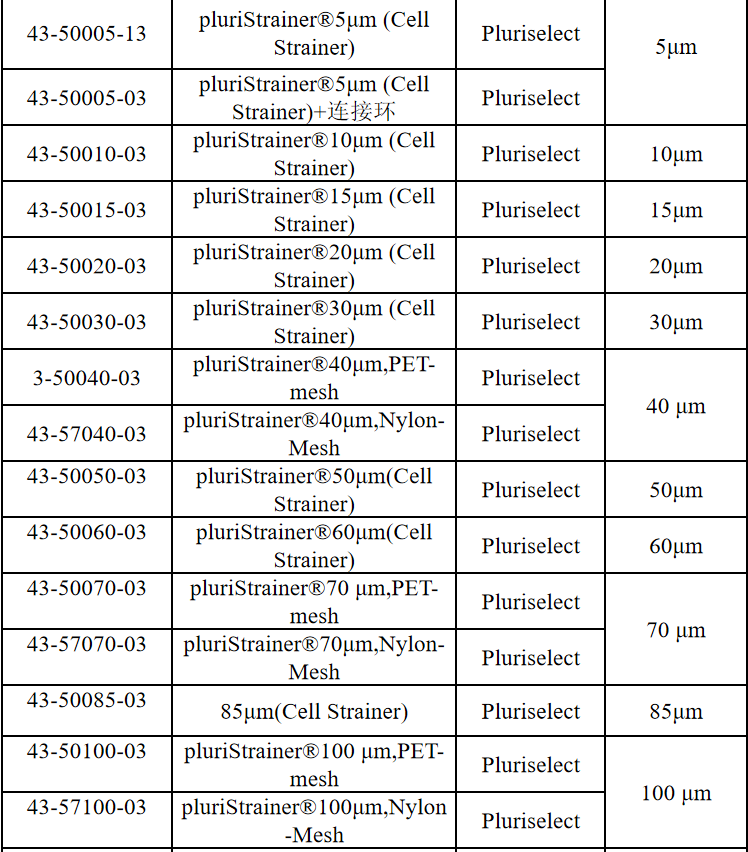
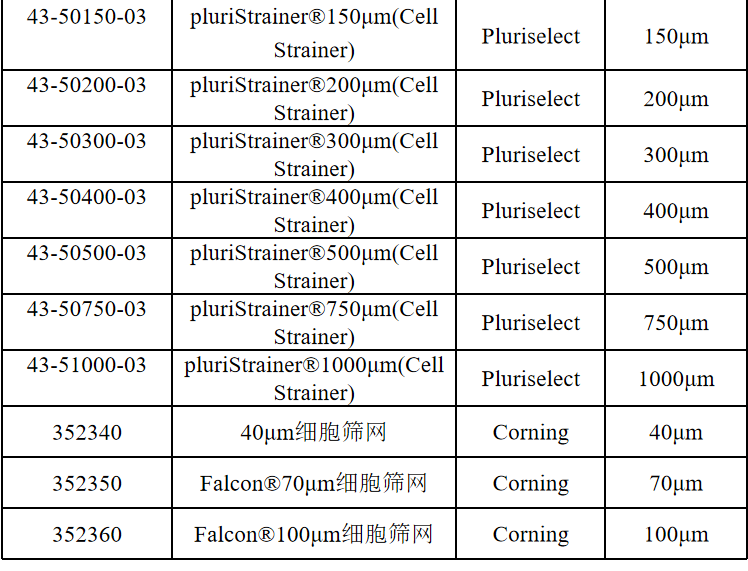
相关产品推荐

其他细胞品类
别划走,精彩继续

长按识别
添加一对一专属技术支持

扫码进群
咨询详细产品信息

点在看,传递你的品味












