【Serumwerk】在碘二醇梯度中纯化组织和细胞的细胞核
组织和细胞的细胞核纯化不成功、实验做不出来怎么办?新手小白迫切求助,希望各位前辈在文章下方留言,分享自己的经验,为小白们答疑解惑!
均质化介质
哺乳动物组织
在许多后续技术中保留的蔗糖屏障方法的一个方面是均质化培养基的性质;含有K+和Mg2+离子的近似等渗溶液通常在分离过程中促进核结构和功能的保留。边缘高渗透性的Blobel和Potter培养基,0.25 M蔗糖含25 mM KCl, 5 mM MgCl₂,最初用50 mM Tris-HCl缓冲,pH 7.4-7.8,被广泛用于啮齿动物的肝脏,缓冲液有一些变化,常被更改为对细胞器更友好的HEPES-KOH或Tricine-KOH,其浓度经常降低到10或20 mM。Provost等在培养基中加入1mm EDTA, Pyhtila等进一步加入1mm DTT。Blobel和Potter培养基也用于大鼠和绵羊的肾脏,啮齿类动物的大脑,脾脏,胸腺和睾丸。在冰冻人脑组织标本的情况下,培养基补充Brij。有时培养基是含有EDTA的0.25 M蔗糖缓冲溶液,或可补充Ca2+,例如0.25 M蔗糖,20 mM HEPES-KOH, pH 7.4, 200 μM氯化钙。
更罕见的是,培养基具有显著的高渗透性:冷冻仓鼠和松鼠的肝脏在25 mM KCl, 1 mM EDTA, 10 mM HEPES-KOH, pH 7.6含40%甘油中均质化。精胺和亚精胺也被用于抑制一氧化氮合酶。低渗溶液更常用于培养细胞,但偶尔也用于组织:大鼠脑组织在25 mM KCl、2 mM MgCl₂、10 mM HEPES- koh、pH 7.5中匀浆,脾脏在20 mM HEPES、10 mM KCl、0.1 mM EDTA、0.1 mM EGTA、1mM DTT、1% NP40中匀浆。
培养的哺乳动物细胞
虽然有使用标准的、或多或少等渗的Blobel和Potter培养基的例子,用于癌细胞、肝癌细胞、上皮细胞、成纤维细胞和平滑肌细胞,但培养细胞的有效均质化可能需要降低总体溶液渗透压和/或二价阳离子浓度和/或包含螯合剂。有时培养基中含有低浓度的非离子型去污剂,这种去污剂对细胞核比质膜更有抵抗力。注意,在所有这些培养基中常规包括多种蛋白酶抑制剂。
无脊椎动物和植物
肌肉组织在含1 mM EDTA的hepes缓冲的Blobel和Potter培养基中均质化。烟草BY2原生质体和拟南芥幼苗的常用溶液为0.4 M蔗糖,10 mM MES, pH 5.3, 10 mM NaCl, 5 mM MgCl₂,5 mM EDTA, 0.1 mM DTT,而拟南芥则添加0.1% TX-100。
OptiPrep方法
不连续梯度
Graham等人设计的最初方法旨在简化纯化程序,因此,与Blobel和Potter方法一样,不需要通过低速离心从匀浆中产生初始的粗核分数。相反,通过与含有与匀浆相同浓度的缓冲液、KCl和MgCl₂的等体积50%碘克沙醇混合,将匀浆简单地调整为25% (w/v)碘克沙醇,并在不连续的碘克沙醇梯度上分层。分离只需要常规的高速离心机,而不是超速离心机,离心时间仅为20 min,比标准蔗糖梯度法至少节省1 h的制备时间。
不连续的梯度-方案的变化
(1)如果细胞在低渗培养基中均质化,通常首先用低速离心将细胞核制成颗粒,然后在25% (w/v)碘克沙醇、25 mM KCl、5 mM MgCl₂缓冲液中重悬。为了避免在梯度前使细胞核成球,首先将匀浆在40%碘克沙醇垫上300 g离心15分钟;在果蝇和秀丽隐杆线虫中,垫层是纯OptiPrep。
(2)由于省略了35% (w/v)的碘克沙醇层,某些梯度变化导致细胞核颗粒化而不是在界面上条带化。
(3)在某些情况下,梯度改变,但高于35% (w/v)碘克沙醇层的核带通常保留,例如:
1.匀浆层状超过12.5%和35% (w/v)碘克沙醇
2.10%、20%(核分数)、25%、30%和35% (w/v)碘克沙醇
3.匀浆分层超过30%和35% (w/v)碘克沙醇
4.匀浆调整为17.5% (w/v)碘克沙醇
5.核颗粒在0.32 M蔗糖缓冲液中,分层超过25%,30%和35%碘克沙醇
6.核颗粒在0.25 M蔗糖缓冲液中,在15%、20%和35%碘克沙醇上分层
7.植物核通过沉积在15%/45%碘克沙醇界面分解
离心条件通常与推荐的重力和时间偏差相对较小,只有少数显著的例外。在较温和的条件下,植物细胞核倾向于显带,例如3000 g 30分钟和1500 g 15分钟;巨噬细胞和肝癌核也被用于较低的g力(4,500 g作用30 min)。显著较大的g力很少使用;贻贝组织和鼠脑细胞核分别在10万g 2小时和27万g 3小时中显带。
密度障碍
一种更简单的变化是将匀浆或粗核组分在密度屏障(通常为29- 30% (w/v)碘克沙醇)上分层,在大约离心时,核颗粒通过密度屏障。10000 g 10- 40分钟;这种方法已用于脑组织和玉米胚芽鞘。一个更简单的选择是将样品调整到20-30% (w/v)碘克沙醇,其中细胞核沉淀,而其他细胞器保持悬浮液(使用12,000 g 4分钟和10,000 g 10分钟)。这种方法已经被用于癌细胞,HEK和卵巢细胞,并且Guilluy等详细描述的分离经常重复。Palmowski等人描述了在20% (w/v)碘克沙醇中进行更长时间离心40分钟的脑核的类似系统。一个更不寻常的变体是使内皮细胞核以20,000 g的浓度通过6% (w/v)碘克沙醇屏障,仅持续30秒。
在一项质粒DNA进入细胞核的研究中,Cohen等人比较了用于溶解所有非核膜的广泛使用的去离子化方法和OptiPrep™方法,发现后者“产生的细胞核中粘附在细胞核外的质粒明显较少”。
相关产品推荐
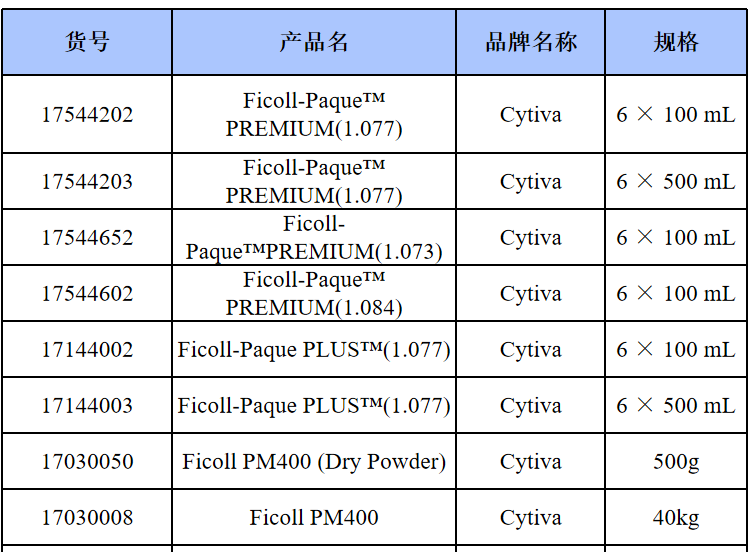
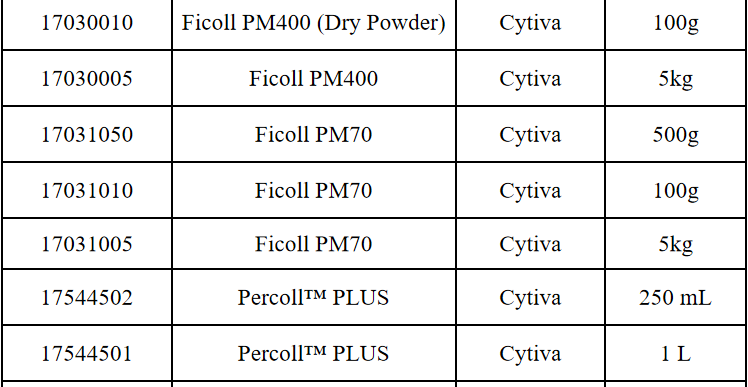
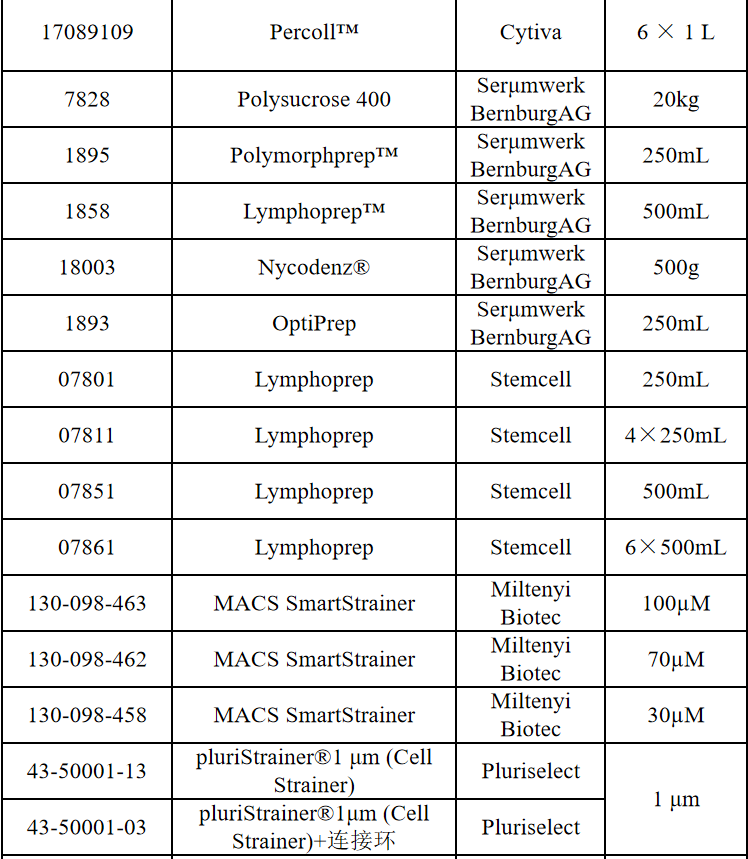
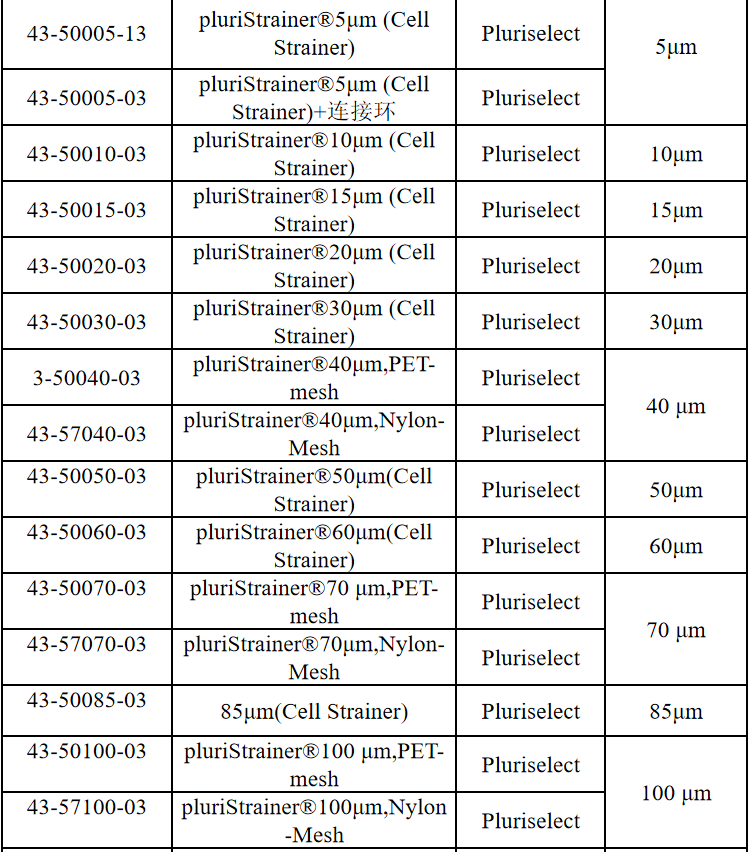
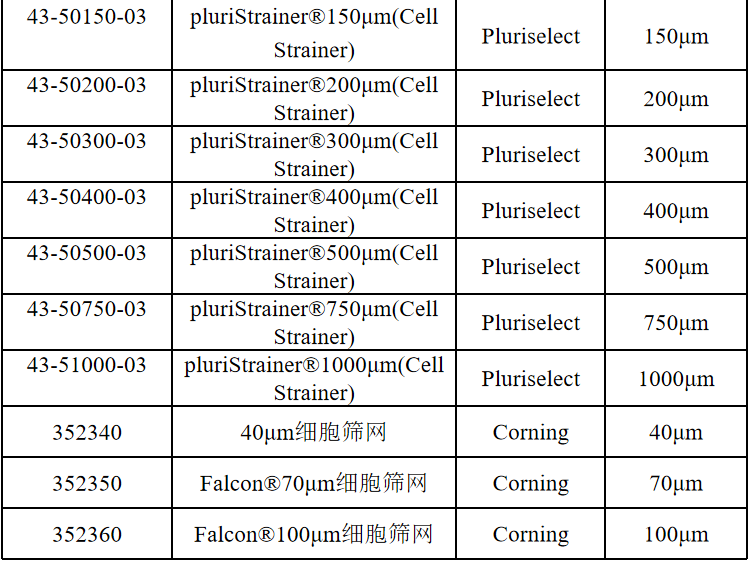
其他细胞品类
别划走,精彩继续

长按识别
添加一对一专属技术支持

扫码进群
咨询详细产品信息

点在看,传递你的品味












