【Serumwerk】差速离心法分离哺乳动物组织和培养的细胞
哺乳动物组织和培养的细胞分离不成功、实验做不出来怎么办?新手小白迫切求助,希望各位前辈在文章下方留言,分享自己的经验,为小白们答疑解惑!
均质化培养基
用于颗粒均质化、洗涤和重悬的溶液取决于待纯化的细胞器。用于大鼠肝脏和其他软组织的研究,一般含有蔗糖作为渗透平衡剂。
A. 一般用途:0.25 M蔗糖,1 mM EDTA, 20 mM Hepes-KOH, pH 7.4
B. 细胞核:作为一般用途,但用25毫米KCl, 5毫米MgCl2取代1毫米EDTA。
C. 过氧化物酶体:向溶液A中加入0.1% (v/v)乙醇。
D. 线粒体:0.2 M甘露醇,50 mM蔗糖,1 mM EDTA, 20 mM HEPES-KOH, pH 7.4。
许多培养的细胞也可以在通用培养基或其他类似的等渗培养基中均质化,。如果匀浆是在低渗培养基中进行的,则应在匀浆完成后尽快将其调整为蔗糖和其他添加剂的推荐浓度。在尝试进行任何差速离心法之前,通过相差显微镜检查均质化过程已成功地打破至少90%的细胞是非常重要的。
试验方法
所有操作均应在0-4℃下进行,所有溶液均应在冰上预冷却。
1.如果要处理核团,用四层粗纱布或细尼龙网(孔径75µm)过滤匀浆,去除任何未破碎的细胞和结缔组织。这种过滤对培养的细胞通常不需要。
2.通过1000gav离心10分钟将核部分制成颗粒。
3.将核后上清液以3000gav离心10分钟,将重线粒体组分制成颗粒。
4.将重线粒体上清液以15,000-17,000gav离心10分钟,将轻线粒体部分制成颗粒。
5.通过以100,000gav离心轻线粒体上清液45分钟将微粒体部分制成颗粒。
6.用宽松的Dounce匀浆器(约为。0.5 mm间隙)以确保颗粒的完全分散。
方法注释
1.核颗粒的离心通常在一个摆动的桶转子中进行,而不是一个固定角度的转子。在这种情况下,与其他粒子相比,核和碎片是如此之大和迅速沉降,以至于这种转子的长路径长度并不是一个真正的缺点。
2.为了提高较慢沉降颗粒的回收率和提高差速离心馏分的纯度,可能需要对颗粒进行清洗,在这种情况下,重悬颗粒应调整到匀浆体积的一半左右,然后以相同的速度和时间离心。然后将两种上清液合并,然后进行下一步离心。
3.有时这种清洗可以延长到三个或更多的重悬和再离心循环;例如,用于从3000g颗粒中纯化线粒体。
4.虽然洗涤程序可以提高颗粒的回收率和/或纯度,但应始终将最大限度地减少造粒和重悬的量作为主要目标,因为这将导致颗粒逐渐破碎。
颗粒的组成
对于常用的组织(如哺乳动物的肝脏),通过差速离心法产生的各种组分的组成已经明确,但对于许多培养的细胞,各种膜颗粒的分布还不太清楚。核球除含有细胞核外,还含有线粒体、成片的质膜(如果有),如果匀浆未过滤,则含有完整的细胞和碎片(包括结缔组织)。有时以500g而非1000g来实施该颗粒的形成。
重线粒体颗粒主要含有含有相当少污染物的线粒体,并且是用于呼吸研究的这些细胞器的常见来源。微量成分如溶酶体、过氧化物酶体、高尔基体膜和各种膜囊泡的存在主要是由于造粒过程中的包封。也可能存在一些质膜碎片。可通过反复清洗来减少这些污染物。
轻线粒体颗粒包含线粒体、溶酶体、过氧化物酶体、高尔基体膜和一些内质网。在所有的差速离心法中,它在实际使用的离心参数方面变化最大:15- 20000 g的g力和10- 20分钟的次数是最常见的。有些方法被设计成保持高尔基体膜的“堆叠”形式,使其在更低的g力下沉淀。
微粒体颗粒定义较好,仅含有膜性囊泡。其中一些囊泡在均质化前就已经存在于细胞中(例如,核内体、分泌囊泡和来自反式高尔基体网络的囊泡),其他来自质膜、高尔基体和平滑内质网和粗面内质网的囊泡将在均质化过程中产生。
颗粒分析
尽管操作者可能只对加工一种颗粒感兴趣,但分析所有颗粒的化学和酶标记(表1)和蛋白质仍然是重要的。这将允许确定回收,不仅是感兴趣的颗粒,而且是难以去除的污染物。应始终包括对细胞质部分(100,000g上清液)的分析;这不仅可以对细胞器标记物进行完整而有价值的“记录”,还可以提供在均质化过程中细胞器可能被破坏和随之释放的细胞器内容物的信息。
其他病原体
在早期Percoll屏障和连续蔗糖梯度的基础上添加最终的连续10-50% (w/v)碘克沙醇梯度,以改善原生动物bieneusi(一种在灵长类动物粪便中发现的寄生虫,引起主要胃肠道症状,尤其是艾滋病患者)的孢子的纯化。此外,这一额外的纯化步骤不会导致恢复的任何损失(与早期密度梯度步骤相关的问题)。梯度是10- 50% (w/v)碘克沙醇(OptiPrep™用0.25 M蔗糖/1 mM EDTA/10 mM Tris-HCl, pH 7.4稀释)在30000 g离心60分钟。来自前一个梯度的最稠密的孢子在碘克沙醇梯度中进一步分解为两个不同的种群,中位密度为1.15和1.16 g/ml。与上文所述的肌孢子菌神经细胞分离一样,碘克沙醇梯度显示出其他密度梯度培养基所缺乏的分解不同类型细胞的能力。OptiPrep™生产的梯度也被用于纯化Mattesia orzaephili卵囊。
从细菌、有机物和工程纳米材料中分离原生动物
在农业和消费品加工中使用碳纳米管的新技术需要有效的方法将这些合成颗粒从原生动物、细菌和残留粪便物质等生物颗粒中分离出来。Mortimer等开发了碘克沙醇梯度,可以实现这些类型的分离。在初始离心(5 min,600 g)后,大部分细菌和游离纳米管(上清液)仍保留在上清液中。为了从成球材料中去除剩余的无纳米管,将后者重悬浮;超过10% (w/v)碘克沙醇分层并在约离心。1800 g 5分钟。在20%碘克沙醇的条件下,将颗粒材料再次离心(相同的重力和时间),从颗粒细菌和粪便物质中分离出原生动物(界面)。环境中大量有机和无机化合物的命运是一个重大的全球问题:利用碘克沙醇梯度研究了嗜热四膜虫对石墨烯的摄取,而碘克沙醇梯度已成功用于检测土壤样本中的弓形虫卵囊。
相关产品推荐
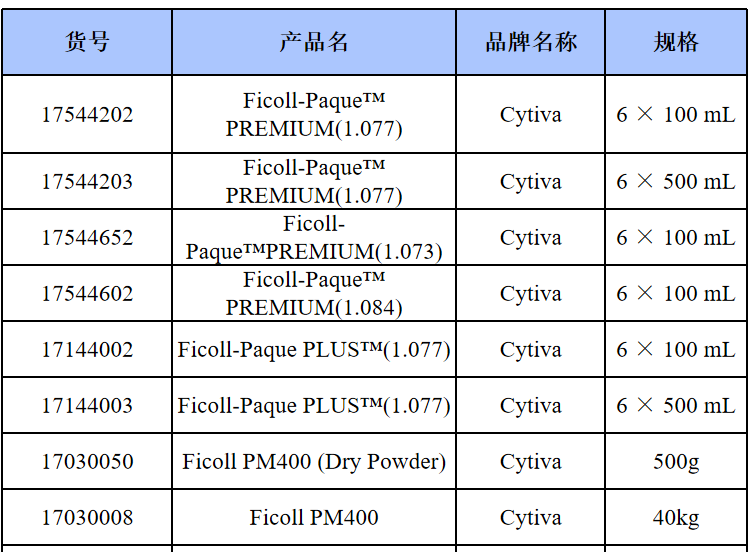
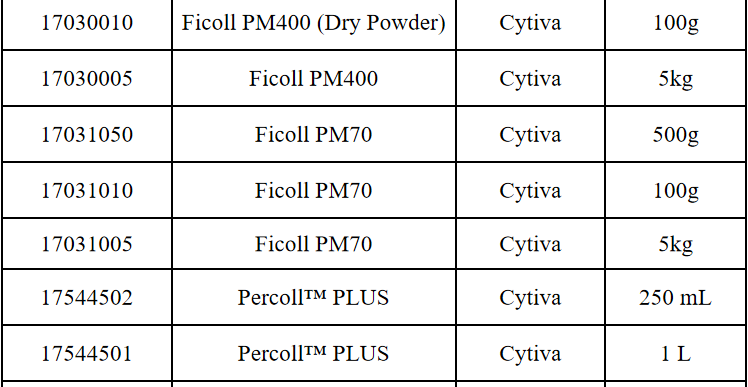
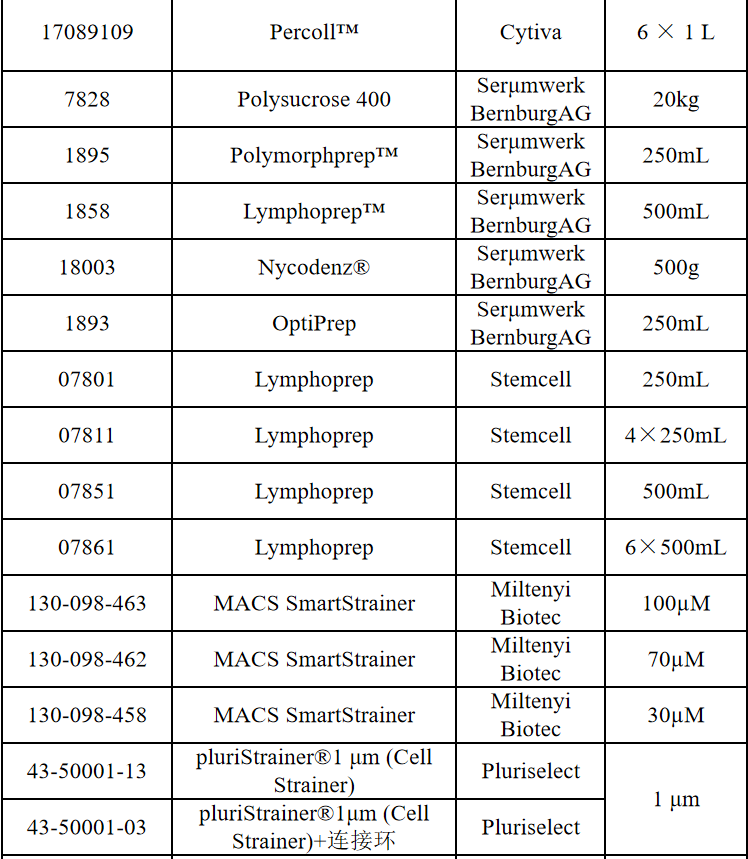
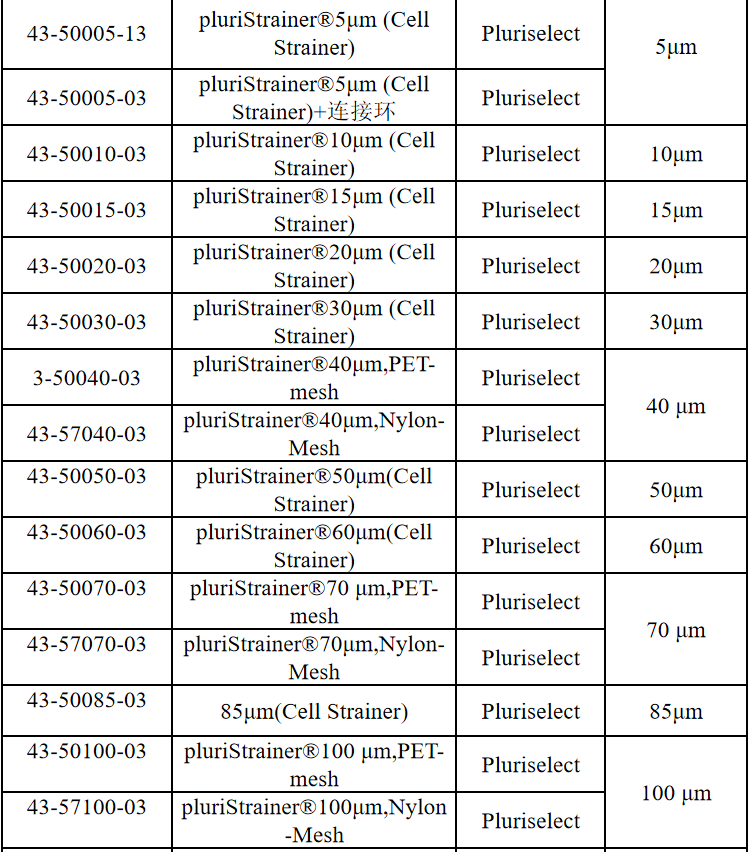
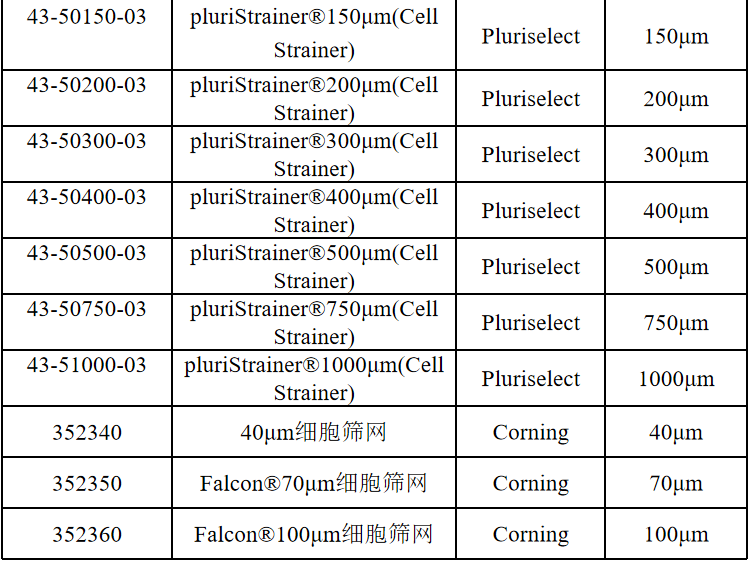
其他细胞品类
别划走,精彩继续

长按识别
添加一对一专属技术支持

扫码进群
咨询详细产品信息

点在看,传递你的品味












