【Serumwerk】刚地弓形虫孢子囊与卵囊壁(Sporocysts and oocyst walls of Toxoplasma gondii)的分离
刚地弓形虫孢子囊与卵囊壁分离不成功、实验做不出来怎么办?新手小白迫切求助,希望各位前辈在文章下方留言,分享自己的经验,为小白们答疑解惑!
溶液制备
A. OptiPrep™(使用前轻轻摇动)
B. 稀释剂:0.25 M蔗糖,15 mM Tris-HCl,pH 7.5
试验方法
1. 使用玻璃珠和涡流将卵囊破碎。
2. 用溶液B稀释OptiPrep™,制备以下密度梯度溶液:2.5%,5%,10%,15%,20%,25%和30% (v/v) OptiPrep™。对于底部加载,省略30%的OptiPrep™。
3. 仅用于底部装载:混合7 体积碎片卵囊悬浮液与3体积OptiPrep™(即调整悬浮液为30% v/v OptiPrep™),并使用此替代30% OptiPrep™(步骤1)。
4. 从等体积(1-2 ml)的每一种碘克沙醇溶液制备不连续梯度;分层可能是创建渐变最简单的方法。
5. 对于顶部加载,用2.5% v/v OptiPrep™加载破碎的卵囊梯度。
6. 大约1000 g离心1小时(见注6)。减速时不要使用刹车。
7. 采集完整的孢子囊,其带在5%到15%的碘二醇之间,卵囊壁在25%/30%的界面上带。
方法注释
1.Everson等研究了步频间隔均为2.5%和5% OptiPrep™的梯度。
2.使用金属套管连接到1-2毫升注射器是创建多个步骤梯度的最佳方法。或者,可以使用小体积(“低脉冲”)蠕动泵引入每一层,密集端先。用泵将分馏的溶液吸起来,然后反向流动,排出到离心管中。
3.由于在建立和离心过程中必然发生的混合和扩散,梯度将或多或少地变得连续(特别是如果使用2.5%的步骤)。
4.Dumètre和Dardè使用略不同的间断碘克沙醇梯度30%、25%、20%、15%和5% (v/v)的底部加载。
5.顶部加载的梯度比底部加载的梯度产生的卵囊壁的产率低。虽然在顶部负载的梯度下,孢子囊的产率较高,但一些非孢子卵囊的污染较严重。
6.Everson等人研究了20-100分钟的离心时间。一个小时可能是最佳的,尽管如果使用浮选,一些无孢子的卵囊,发现低于15%的碘克沙醇,可能没有时间达到它们的条带密度。
7.要么抽吸可观察到的带状物质,要么从半月板上仔细抽吸出整个梯度。
相关产品推荐
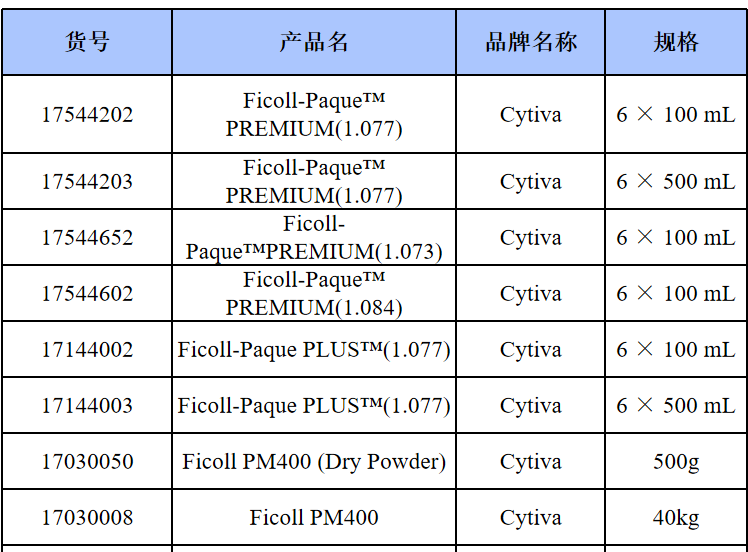
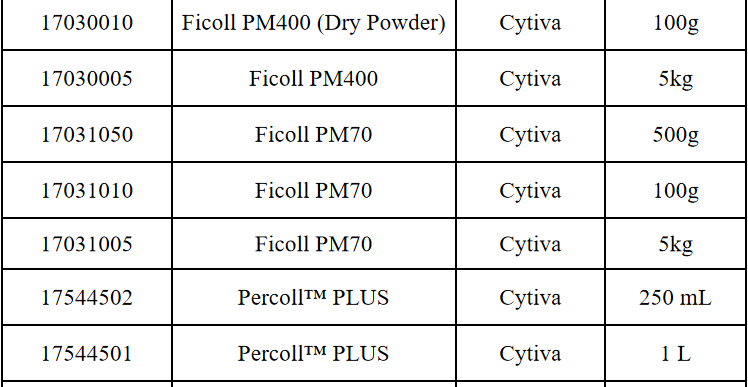
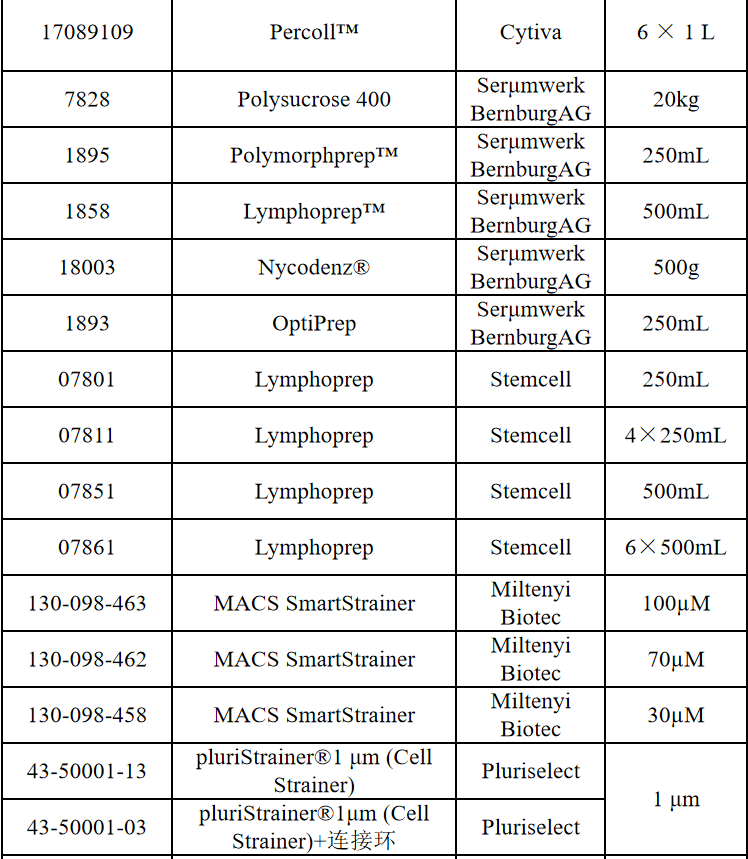
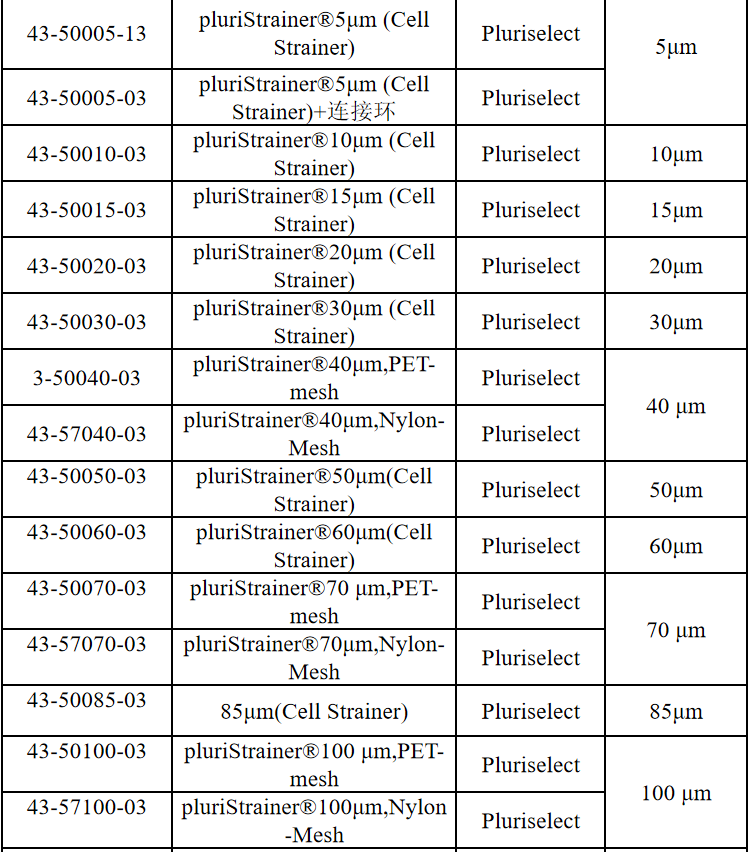

其他细胞品类
别划走,精彩继续

长按识别
添加一对一专属技术支持

扫码进群
咨询详细产品信息

点在看,传递你的品味












