【Serumwerk】对来自果蝇的细胞膜(Membranes from Drosophila)的分析(一)
内质网、高尔基体和质膜(Endoplasmic reticulum (ER), Golgi and Plasma membrane (PM))的分离不成功、实验做不出来怎么办?新手小白迫切求助,希望各位前辈在文章下方留言,分享自己的经验,为小白们答疑解惑!
溶液制备
A. OptiPrep™
B. 洗涤液1:0.7% (w/v) NaCl, 0.03% (w/v) Triton X-100
C. 均质培养基(HM): 0.25 M蔗糖,5 mM EDTA, 10 mM Tris-HCl, pH 7.5
D. KCl: 2M KCl
E. 蔗糖垫:0.5 M蔗糖,0.5 mM EDTA, 50 mM KCl, 15 mM Tris-HCl, pH 7.0
F. 洗涤液2:5 mM EDTA, 50 mM KCl, 10 mM Tris-HCl, pH 7.5
G. 膜悬浮缓冲液:0.25 M蔗糖,50 mM KCl, 5 mM EDTA, 10 mM Tris-HCl, pH 7.5
H. Optiprep™稀释缓冲液:300 mM KCl, 30 mM EDTA, 60 mM Tris-HCl, pH 7.5
I. Optiprep™工作液(50%碘克沙醇):稀释5体积Optiprep™与1体积溶液H。蛋白酶抑制剂可由操作员酌情包含在溶液B、C和E-H中。
试验方法
在0-4℃下执行所有操作。
选项A:在碘克沙醇梯度离心(步骤5)之前,可以简单地将3000 g上清液(来自步骤4)中的膜颗粒化并重悬。
选项B:在碘克沙醇梯度离心之前,可在蔗糖密度屏障上将膜与细胞质蛋白和小污染物分离(步骤6-8)。
1. 脱绒毛膜胚胎1-3小时用溶液B洗涤两次,用溶液C洗涤一次。
2. 将胚胎悬浮在10体积的C溶液中,首先在宽松的Dounce(玻璃玻璃)匀浆器(惠顿B型)中匀浆,然后在紧密型匀浆器(惠顿a型)中匀浆。通过光学显微镜监测匀浆。
3.将溶液D添加至匀浆(分别为0.1体积+ 3.9体积)以调整KCl浓度至50 mM。
4. 将匀浆3000 g离心10分钟以去除碎片和较大的细胞器。
5. 选项A:从3000 g上清液以100,000 g使膜颗粒化1 h(总膜部分)或以20,000 g使膜颗粒化30 min以分离富含高尔基体的部分。
6. 选项B:将3000 g上清液层在溶液E的缓冲层上,在摆动桶转子中以100,000 g离心1小时。
7. 选择B:使用注射器和金属套管(内径0.8-1.0 mm)在不干扰颗粒的情况下尽可能多地抽吸上清液。
8. 选项B:将颗粒重新悬浮在残余溶液中;与5体积的溶液F混合,在10万g离心1小时。
9. 使用注射器和金属套管抽吸步骤5或步骤8中的上清液,大约使用1 ml溶液G重新悬浮颗粒。
10. 准备三种梯度溶液:溶液I,膜悬浮液和溶液G的体积比:3:2:0,2:2:1和1:2:2。
11. 将每一种梯度溶液1.8 ml通过分层、下分层或上分层的方式注入Optiseal™管中,用于接近垂直的转子。
12. 在340,000 gav的离心机上使用缓慢加速程序3小时。
13. 允许离心机在没有刹车的情况下从2000转减速到休息或使用缓慢减速程序。
14. 通过置管、向上移位或从半月板抽吸的方法收集梯度,每次0.25 ml。
方法注释
均质化介质
均质化培养基(HM)通常已专门用于果蝇膜的分割。在该实例中,所述溶液用Tris缓冲,但如优选,可使用Hepes、Tricine或三乙醇胺(在相同浓度下)。缓冲液的类型不太可能显著影响均质化或分馏,尽管对于哺乳动物细胞,三乙醇胺似乎在均质化效率方面提供了一些特别的优势。
如所述的工作溶液(溶液I)的制备,确保KCl, EDTA和Tris缓冲液的浓度在整个梯度中保持恒定,而蔗糖和碘克沙醇作为渗透平衡剂,以维持大约的浓度。常数同渗重摩。如果认为这一点不重要,梯度溶液可以直接从OptiPrep™制备,但如果选择了这一选项,那么KCl、EDTA和缓冲液的浓度将随着溶液密度的增加而降低。
Beronja等人按照研究方案中的描述调整了匀浆中的KCl浓度(50 mM),但Papoulas等人将其调整为100 mM。如果将KCl浓度调整为100 mM KCl,那么所有后续使用的溶液(溶液E-H)也应进行类似调整。
Tan等人在他们的蛋白质组学研究中使用0.25 M蔗糖,1 mM EDTA, 1 mM DTT, 10 mM HEPES, pH 7.4作为均质培养基,在某些情况下渗透平衡剂是NaCl而不是蔗糖,例如150 mM NaCl, 0.2 mM EGTA, 100 mM Tris, pH 7.4。
初步提纯
为了分析主要的膜组分(质膜,高尔基体和内质网),3000 g上清液可以简单地以100,000 g离心以使微粒体颗粒化或通过蔗糖垫层沉淀法进行部分纯化。后者将更有效地去除可溶性蛋白,这些蛋白将主要留在样品区。如果主要目的是分离用于体外孵育的高尔基体,则100,000 g步骤由Papoulas等人替换为20,000 g步骤。
梯度变化
Adolfson等采用了更简单的碘克沙醇梯度格式;将核后提取液调整为26% (w/v)碘克沙醇,在接近垂直的转子中形成30000gav的自生成梯度,而Niimura等人使用的是不连续的2.5% -30% (w/v)碘克沙醇梯度。
方法审查
Niimura等使用的2.5% -30%不连续碘克沙醇梯度中,内质网条带密度高于高尔基体。在Adolfsen等报告的自生成梯度中,突触小泡靠近梯度的顶部,并清楚地区分含有Synaptotagmins 1的低密度小泡和含有Synaptotagmins 4和7的高密度小泡。Paneels等人使用5%,30%,40%的碘克沙醇浮选梯度在5%/30%的界面带质膜。
10-40% (w/v)碘克沙醇梯度(250,000 g,作用3 h)将质膜与细胞骨架分离。一个简单的三层梯度,将1000 g 40%碘克沙醇的上清液分层置于5%和30%碘克沙醇的层下,以100,000 g离心3小时,结果在5%层以下的质膜条带。Tan等人将含有6%和8% (w/v)碘克沙醇的2000 g/5 min上清液置于其中,以100,000 g离心90分钟,在两种碘克沙醇溶液的界面处浓缩膜。将回收的膜调整为12.5%碘克沙醇,在Beckman VTi65.1垂直转子中离心1 h。该方法分离了PM、高尔基体、ER和线粒体。
相关产品推荐
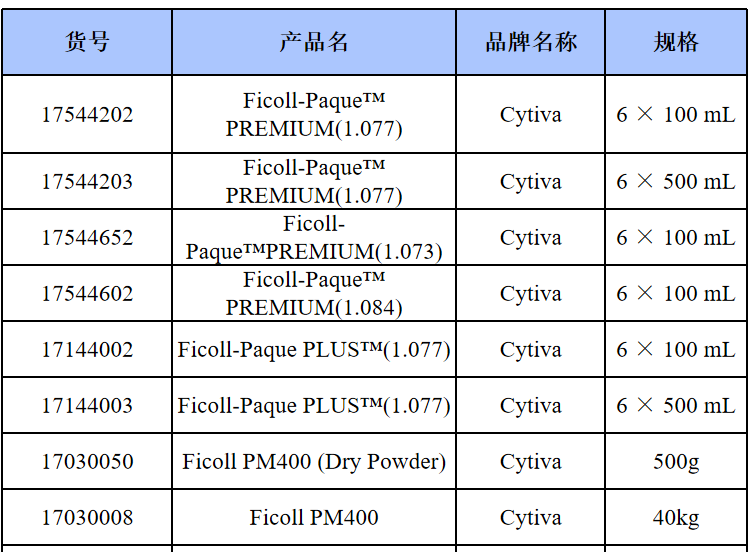
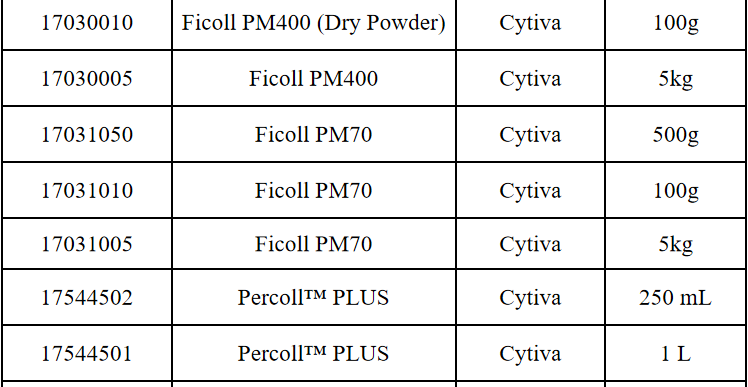
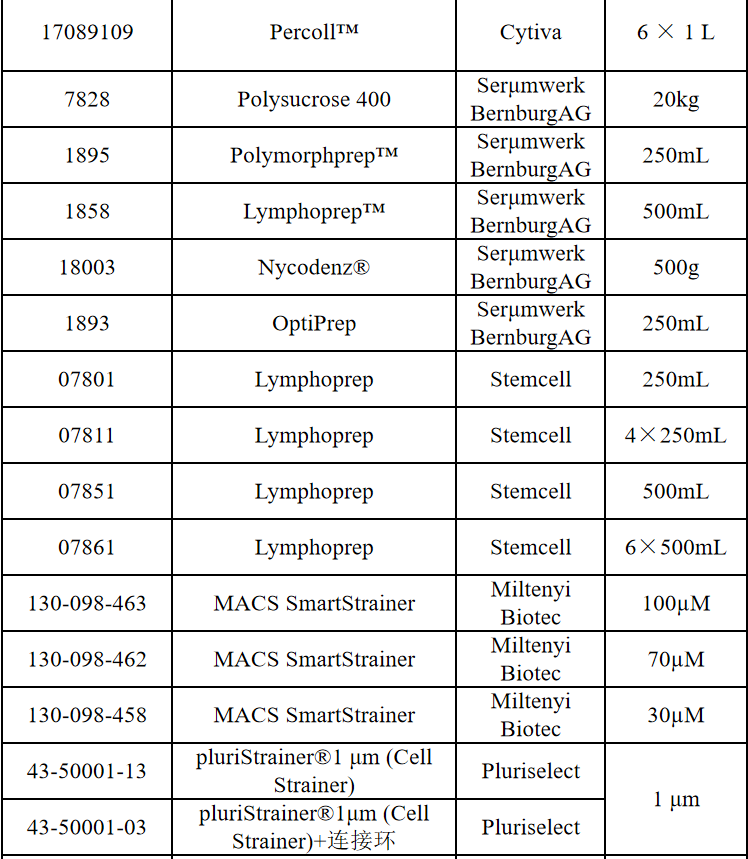
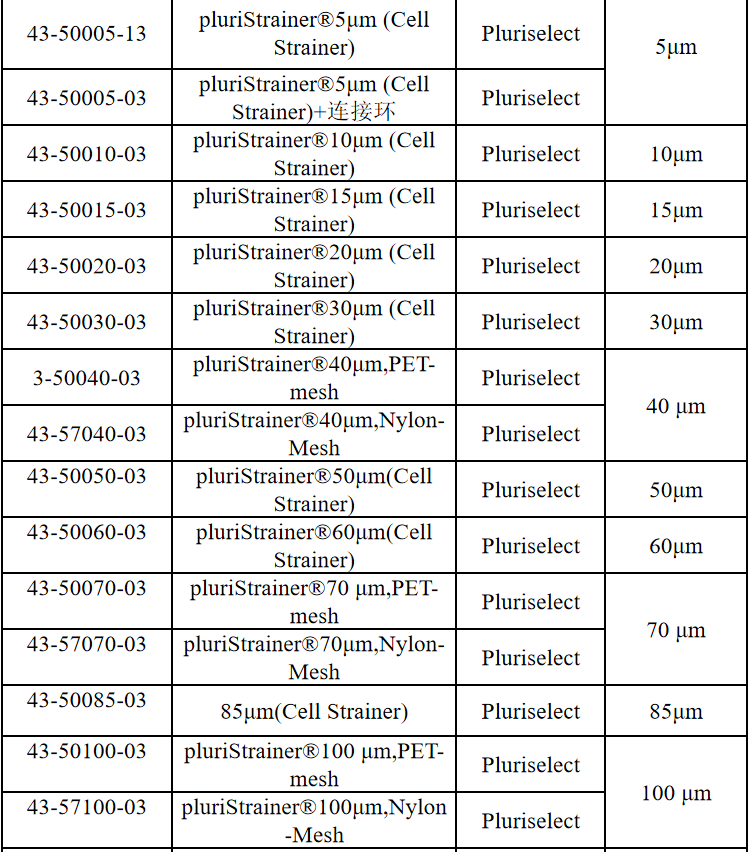
其他细胞品类
别划走,精彩继续

长按识别
添加一对一专属技术支持

扫码进群
咨询详细产品信息

点在看,传递你的品味












