【Serumwerk】叶片原生质体(Protoplasts for leaf tissue)分离
叶片原生质体分离不成功、实验做不出来怎么办?新手小白迫切求助,希望各位前辈在文章下方留言,分享自己的经验,为小白们答疑解惑!
溶液制备
等离子体溶解液:5 mM MES,1 mM磷酸一钾,0.44D山梨醇,5 mM氯化钙,2 mM氯化镁,2 mM氯化锰,1 mM精氨酸,1 mM二硫苏糖醇(DTT),0.1%(w/v)聚乙烯吡咯烷酮(PVP-10),2 mM谷胱甘肽(GSH),2 mM抗坏血酸,0.01%(w/v)大豆胰蛋白酶抑制剂,1300 U /ml过氧化氢酶,调整至pH 5.7。
消化溶液:在溶液A中添加2%(v)纤维素酶和0.5%(v)麦糊酶。
分离缓冲液:作为不含过氧化氢酶或胰蛋白酶抑制剂的溶液A。
OptiPrep™(使用前轻轻摇动瓶子)
工作原液:将0.6 g氯化钾溶解在100 ml溶液D(500 mOsm)中。
如果需要无菌制剂,所有溶液都应进行过滤消毒。
试验方法
叶片渗透压的测定
1. 在液氮中冷冻后,粉碎叶片组织(3 g比较方便)。
2. 在密封管中解冻后,为了排除冷凝,在4℃下以30000g离心20 min。通过降低冰点来测定上清液的渗透压。
3. 消化溶液和梯度溶液的渗透压被设置为组织的1.8倍。
杀菌
如有需要,在处理前,叶片应在含0.01% (v/v) Tween-80的1%次氯酸钠中连续洗涤(5 min)进行表面灭菌;无菌蒸馏水(x3),70% (v/v)乙醇(2 min),最后再次无菌蒸馏水(x3)。这一过程不仅表面消毒组织,而且削弱角质层,从而有助于原生质体释放。
原生质体制备
1. 将叶片组织置于溶液A (50 ml /g组织)中,20℃ 放置30 min。
2. 将叶子从溶液中取出,切成0.5-1mm的碎片,放入含有溶液B (10 ml /g组织)的9厘米培养皿(每个培养皿含2 g组织)。
3. 将组织在20℃下消化3小时,第一次和最后30分钟以40转/分的速度振荡。
4. 消化后用尼龙网(孔径100µm)过滤各培养板的内容物。洗去隔离缓冲液中由网片保留的组织;轻轻捣碎释放更多原生质体,并再次过滤。
5. 用缓冲液将筛网冲洗干净,将每个筛板上的滤液加入50ml 灭菌离心管中,使其体积达到30ml。
原生质体纯化
1. 将7.5 ml溶液E添加到每30 ml消化中以使最终密度接近1.07 g/ml。
2. 用20 ml溶液C(约1.03 g/ml)稀释2 ml溶液E。将10 ml此溶液覆盖于消化混合物上。
3. 最后,将2-3 ml的溶液C铺在上面。
4. 在4℃的摆动桶转子中以200 g将管离心4 min。
5. 离心后,在介质的顶部和上覆缓冲液中发现一条材料带。从该带向下至1.03/1.07 g/ml界面的介质中无物质。1.07 g/ml层含有颗粒材料并且还存在颗粒。
6. 使用塑料巴斯德移液管在顶端收获带,尖端被切断,以增加孔的大小,从而减少对脆弱原生质体的伤害。
7. 上面的条带包含超过95%的完整原生质体,剩下的只是显示出溶解和释放叶绿体的迹象。保留在1.07 g/ml层中的完整原生质体数量并不显著。
方法注释
1.小麦和大麦叶片以外的植物材料可能需要对两个梯度层的密度进行小的修改。在计算产生特定密度所需溶液C和E的体积时,必须考虑到两种溶液的密度。
2.这种制备实际上不需要离心:原生质体的大小意味着它们在1 g时大约30分钟就会浮到密度屏障的顶部。
3.大麦原生质体的恢复约为每克组织4×106;使用小麦,产量明显较低。
4.收获的原生质体悬液含有少量的1.03 g/ml的层(约2%碘克沙醇),对原生质体没有任何影响。
5.原生质体浓度高,没有任何残留的酶活性,因此不需要洗涤。将任何细胞(特别是脆弱的植物原生质体)制成颗粒来洗涤而且几次复苏是非常有害的。
6.这种方法是为小麦或大麦的叶子开发的。它也被用于从草甘油中纯化原生质体。该方法还用于江蓠龙须草的浮选(股薄目,红藻目)尽管梯度被修改为:粗馏分悬浮于34.8% (w/v)碘克沙醇(约1,189 g/ml)和19.2%碘克沙醇(约1,189 g/ml)的溶液中。1.105 g/ml)和0%碘克沙醇分层顶部(所有溶液均含有人工海水)。160 g离心10分钟后,原生质体在0%/19.2%碘克沙醇界面条带。
相关产品推荐
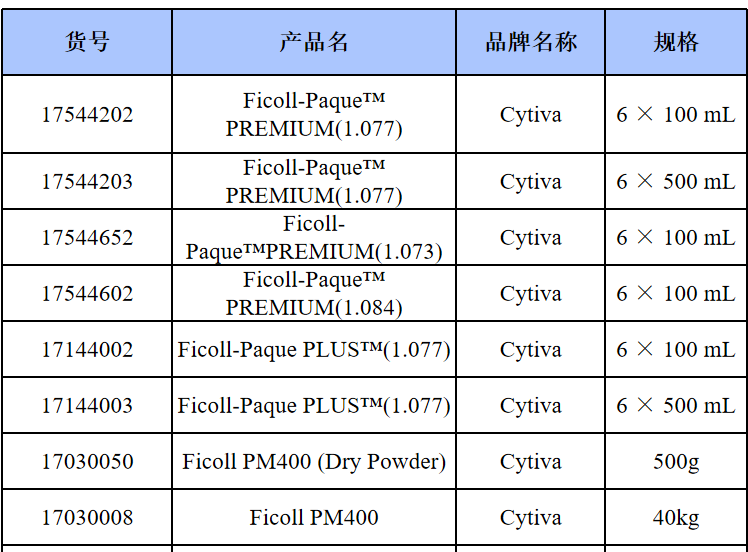
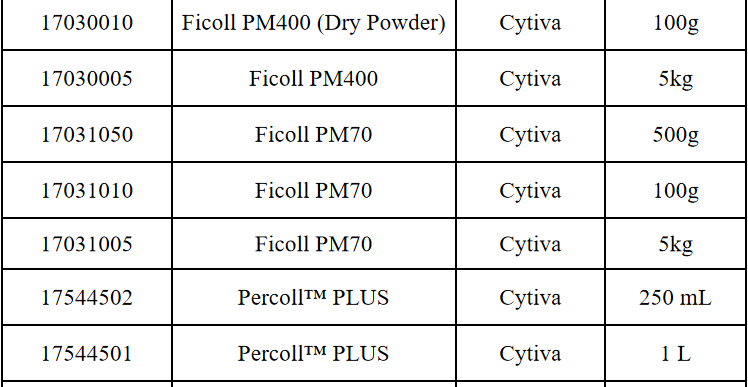
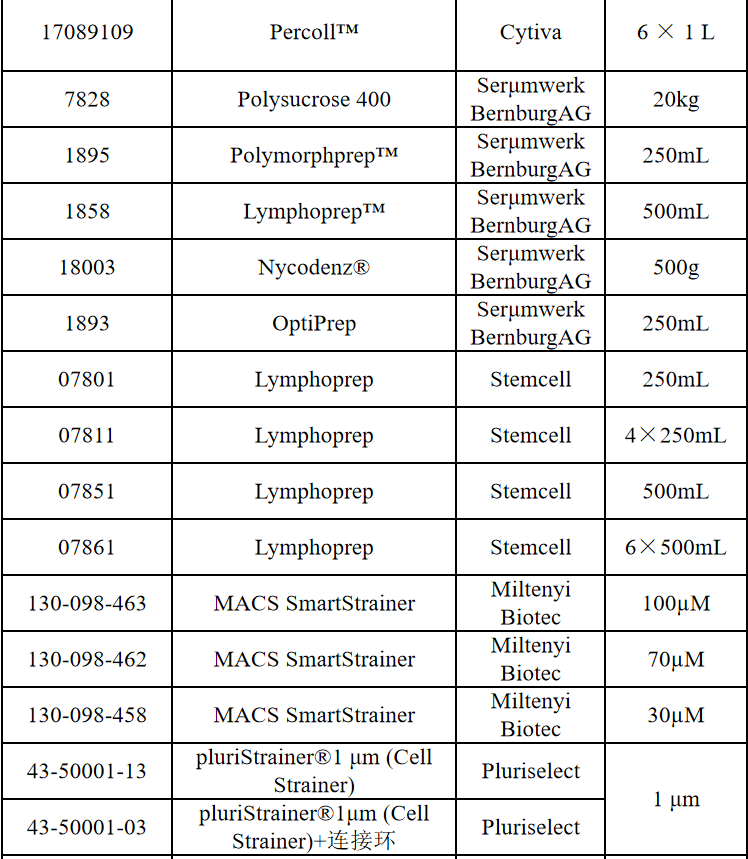
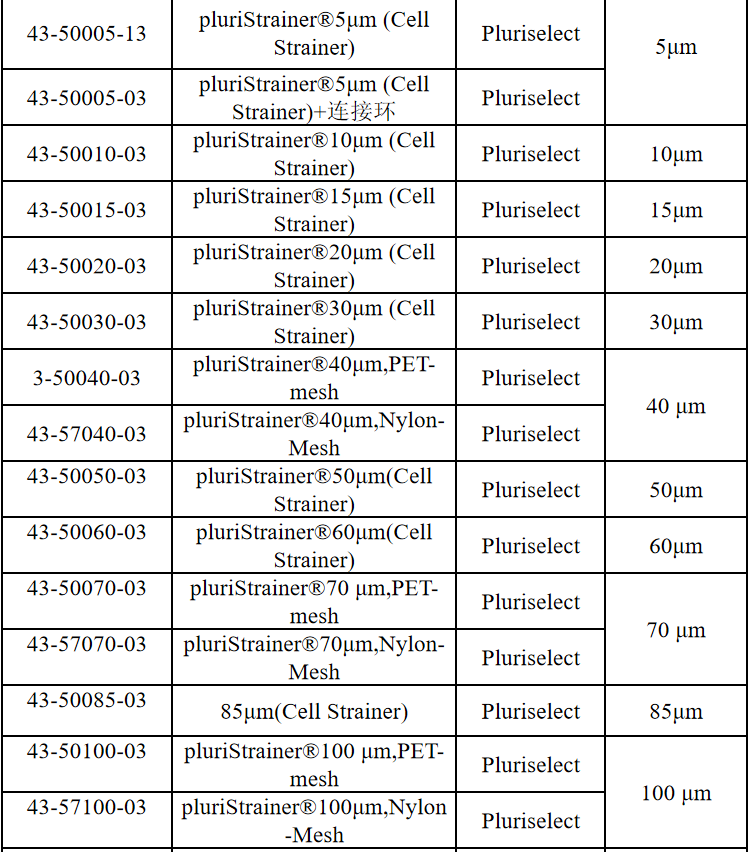

其他细胞品类
别划走,精彩继续

长按识别
添加一对一专属技术支持

扫码进群
咨询详细产品信息

点在看,传递你的品味












