【Serumwerk】混合细胞(A mixed population of cells)分离
混合细胞分离不成功、实验做不出来怎么办?新手小白迫切求助,希望各位前辈在文章下方留言,分享自己的经验,为小白们答疑解惑!
溶液制备
A. OptiPrep™
B. OptiPrep™稀释液:0.85%(w/v)氯化钠,40 mM HEPES-NaOH,pH 7.4
C. 工作溶液(WS)稀释剂:0.85%(w/v)氯化钠,20 mM HEPES-NaOH,pH 7.4
试验方法
碘二醇工作溶液制备
1. 使用前请轻轻摇晃OptiPrep™。
2. 将等体积的OptiPrep和溶液B混合,制成30% (w/v)的碘克沙醇工作溶液(ρ= 1.16 g/ml),用溶液C进一步稀释,制成密度较低的溶液。
制备用于梯度加载的细胞悬液
方法一
如果在随后的分离,细胞层在梯度上:收获细胞带(采取尽可能少的密度屏障)。用2体积的溶液C稀释悬浮液,以250-400g左右的浓度将细胞颗粒沉淀10-20分钟。在溶液C中重新悬浮细胞颗粒。如果在后续的分离中,细胞将在梯度下面分层:尽可能丢弃最上层的细胞,收获细胞条带和大部分密度屏障,但避免颗粒。然后轻轻地混合以重新悬浮细胞:悬浮的密度应该约为1.12 g/ml。
方法二
如果在随后的分离中,细胞将在梯度上分层:在培养基的最上层收获细胞带(取尽可能少的1.12 g/ml层),并用3体积的溶液C或培养基稀释。如果细胞悬浮的密度不低于后续梯度顶部的密度,则必须将细胞颗粒化并重新悬浮。如果在随后的分离中,细胞将在梯度下面分层:尽量丢弃最上层的培养基,并在1.12 g/ml的层中收获4-5 ml的细胞条带。这种悬浮液的密度可能需要通过与小体积的1.16 g/ml碘克沙醇工作液混合来提高。
浮力密度分馏
1. 准备一个预制的连续梯度,其密度范围为1.03 - 1.10 g/ml(这大约相当于5-20% (w/v)碘克沙醇)。或者构造具有覆盖相同密度范围的若干层的不连续梯度。
2. 将回收的细胞样品分层置于梯度的下方或上方,并在20℃(或4℃)的摆动桶转子中以800-1000 g离心20-30 min。
3. 确定每个条带中的细胞类型,在离心过程中,它们将以各自的浮力密度条带。
根据细胞大小进行的分馏
1. 如果有两种不同大小、相同浮力密度的细胞,较大的细胞会比较小的细胞更快地沉淀(或漂浮),直到它们达到与浮力密度相等的梯度点。随着继续离心,较小的细胞将到达相同的点。所以离心时间在大小分离中很重要。
2. 将细胞悬浮于溶液C中并将其分层于预先形成的连续梯度(约1.03-1.09 g/ml)之上。
以600 g离心10分钟,并检查是否已分离。如果没有,可以尝试其他的离心时间(8、12、15分钟等)。
方法注释
1. 按照所述制备的所有梯度溶液的渗透压均在290- 305 mOsm范围内。溶液B的缓冲浓度是溶液C的两倍,因此梯度溶液中的缓冲浓度(因此在梯度中)是恒定的。同样的原理可以应用于任何其他低浓度添加剂,这些添加剂可能被认为是维持细胞活力梯度的重要组成部分,例如1-2 mM的MgCl2和/或CaCl2。如果这一点不重要,那么溶液B和C可以是相同的,可以是任何等渗缓冲盐水、平衡盐溶液或常规培养基;这些置换都不会对梯度溶液的最终密度或渗透压摩尔浓度产生显著影响。如果包含10%的血清,那么这将略微增加所有溶液的密度。
2. 在某些情况下,分离可受益于梯度溶液的离子强度的小幅增加;或使用明显高渗的培养基可能有利于特定细胞类型的分离。
3. 如果省略了去除不可活细胞的步骤,则可将细胞直接悬浮于高密度溶液(约22.5% (w/v)碘克沙醇或Nycodenz)中用于底部加载,或悬浮于溶液C中用于顶部加载。
4. 在某些情况下,在4℃下进行离心可能是有益的,在这种情况下可能需要增加离心时间。
6. 不连续梯度的分辨能力取决于相邻层的密度区间。在任何界面上条带的细胞在两层之间将有一个密度范围。
7. 如果感兴趣的单元格与其他类型共带,那么梯度可能太陡而无法解析它们,在这种情况下,可能需要较浅的梯度(或覆盖较小密度区间的层)。另外,不同的细胞类型可能具有相同的密度,仅根据大小可分离。
8. 如果所有的细胞带要么朝向梯度的顶部或底部,它的密度范围应该被调整以避免这种情况。
9. 以沉降(或浮选)速率为基础的分辨率与样品的深度成反比;因此,样品体积必须保持在最低限度。
相关产品推荐
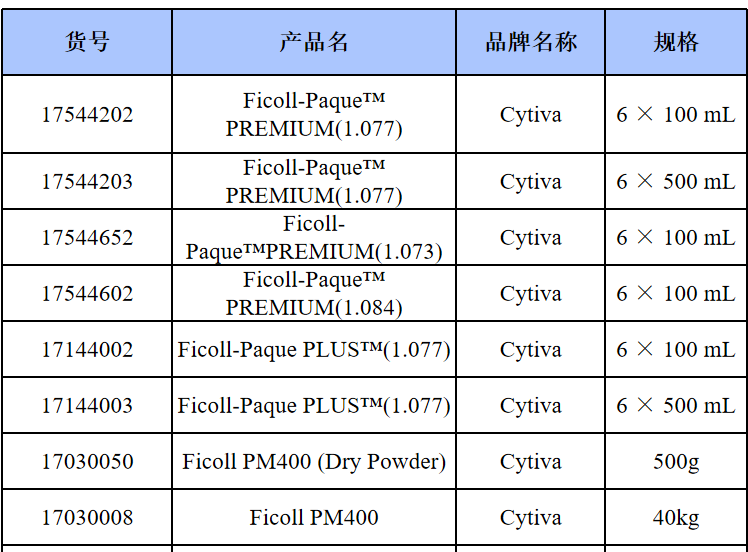
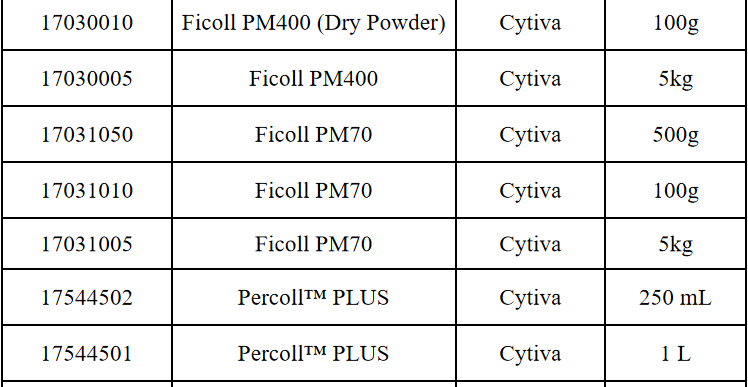
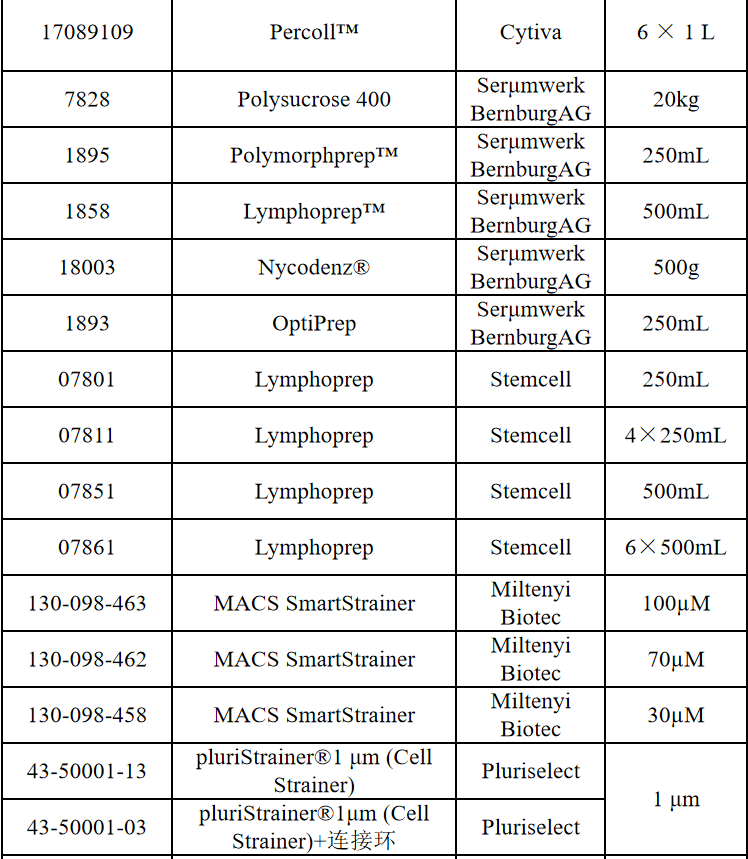
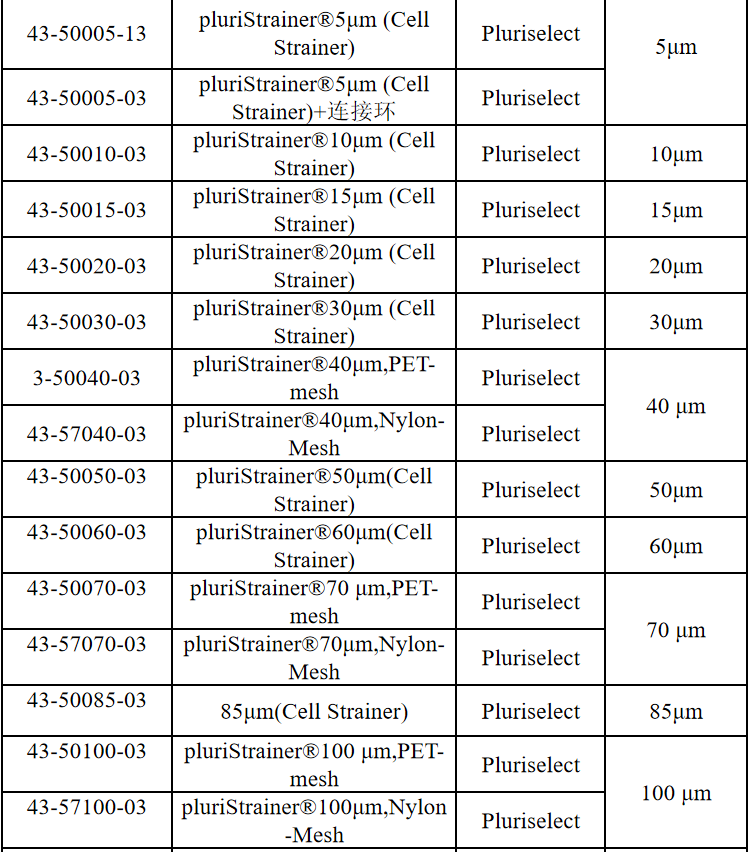

其他细胞品类
别划走,精彩继续

长按识别
添加一对一专属技术支持

扫码进群
咨询详细产品信息

点在看,传递你的品味












