【Serumwerk】神经相关细胞(Nerve associated cells)纯化
神经相关细胞纯化不成功、实验做不出来怎么办?新手小白迫切求助,希望各位前辈在文章下方留言,分享自己的经验,为小白们答疑解惑!
小鼠大脑神经胶质细胞(Glial cells from mouse brain)的纯化
溶液制备
A. OptiPrep™(使用前轻轻摇动瓶子)
B. Hank’s平衡盐溶液
试验方法
1.用溶液B稀释OptiPrep™制备以下碘二醇溶液:四步梯度为4%、5.5%、7%和10%(w/v)碘二醇,或两步梯度为9.6%和21.6%(w/v)碘二醇。
2.通过70 μm的筛,粉碎脑组织。
3.将绞碎物悬浮于溶液B中并通过以下方法之一解离组织:
(a) 每个脑在室温下500 μg木瓜蛋白酶处理20 min,随后在37℃下DNase I (1 mg/ml)处理5 min
(b) 在37℃下0.25%胰蛋白酶和0.1 mg/ml DNase I处理20 min。
4.用B溶液稀释悬液,1500g离心10 min,获得细胞。
5.将细胞颗粒重新悬浮于溶液B(四步梯度)或21.6%(w/v)碘二醇溶液(两步梯度)中。
6.对于四步梯度,每层4%、5.5%、7%和10%(w/v)碘二醇,每层细胞悬浮液或两步梯度层9.6%(w/v)碘二醇在21.6%(w/v)碘二醇。
7.3000 g离心20 min(四步梯度)或670 g离心20 min(两步梯度)。
8.在四步梯度中,最下一层的小胶质细胞条带;在两步梯度中,它们在界面处形成条带。
去除髓磷脂以纯化细胞组分
将解离的细胞悬液与OptiPrep™混合,使最终碘克沙醇浓度为9% (w/v),并以800 g离心20 min。丢弃上清液中的髓鞘,并在适当的培养基中收集含有细胞的部分。
方法注释
1.任何合适的培养基-缓冲盐水溶液或培养基都可以用来代替Hank’s平衡盐溶液。
2.O‘Mahony等人使用的梯度包括9%、12%、15%和21%(w/v)碘二醇,这是用Hibernate A/B27 培养基稀释OptiPrep™制备的。而最近Song等人和Hong等人通过7.5%、10.0%、13.5%和17%的梯度培养小胶质细胞(800g)。
3.Tsuchiya等对这一步采用了5 min离心。
4.更大的梯度体积可以提供更好的分辨率。
5.不连续的梯度通常最容易用注射器(2 ml)和长金属套管分层(即低密度);叠加溶液,特别是那些密度相差很小的溶液,更困难。
6.Tsuchiya等人的指定了这一步的温度为24℃。
7.将O‘Mahony等人描述的梯度体系在800 g下离心15 min。离心后,将梯度前6 ml作为含碎片丢弃,然后观察含有(1)少突胶质细胞、(2)神经元+胶质附属细胞、(3)神经元和(4)小胶质细胞的密度增加带。
8.6%或6.2%(w/v)碘二醇屏障也被用于神经元和胶质细胞的分离。
9.Tucsek等人采用屏障浮选法;细胞悬浮在约21%(w/v)碘二醇(用Hank’s平衡盐溶液稀释OptiPrep™),并覆盖9.6% 碘二醇。在670 g条件下处理20 min后,从界面上收获小胶质细胞。
少突胶质细胞(Oligodendrocytes)纯化
少突胶质细胞已在从OptiPrep™制备的四阶梯梯度上分离出来,其纯度>90%。少突胶质细胞趋向于相对低密度并从梯度的上层收集。
星形胶质细胞(Astrocytes)纯化
使用10 mM MOPS - 137 mM NaCl稀释OptiPrep™获得约29.7% (w/v)碘克沙醇(ρ = 1.161 g/ml)的工作溶液(WS);用含10%胎牛血清(FBS)的DMEM进一步稀释。
完全培养基(含FBS)具有约1.009 g/ml的密度。然后使用此来稀释碘克沙醇WS以产生所需溶液。
将包含各1 ml梯度溶液的不连续梯度用6 ml粗制细胞部分覆盖并在800g离心15分钟。星形胶质细胞在1.062/1.056 g/ml界面呈带状分布。
相关产品推荐
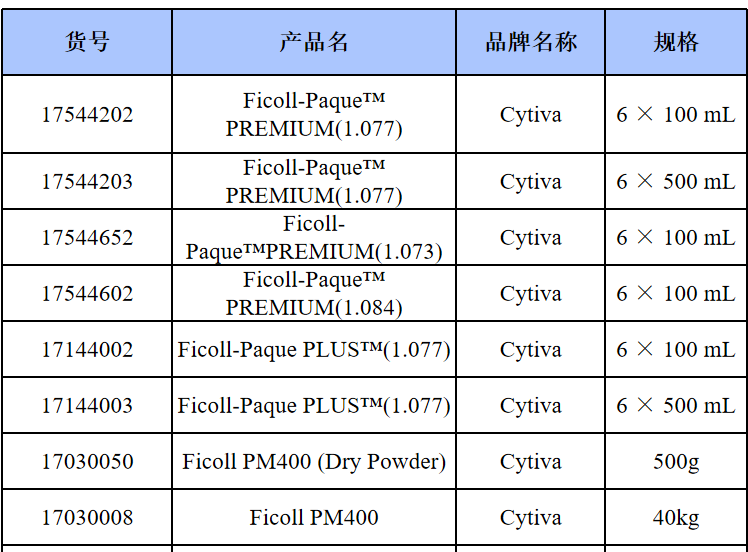
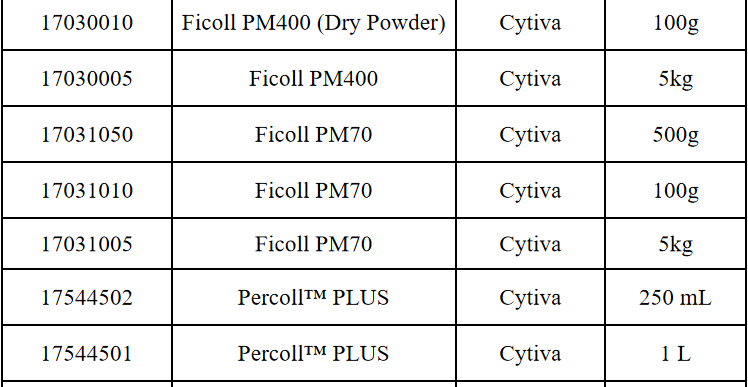
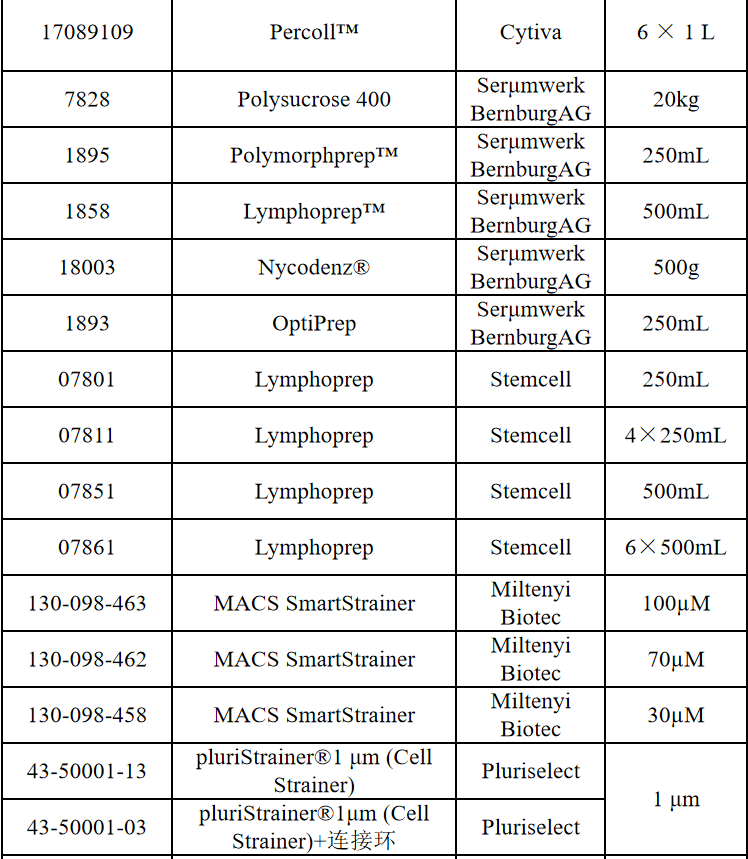
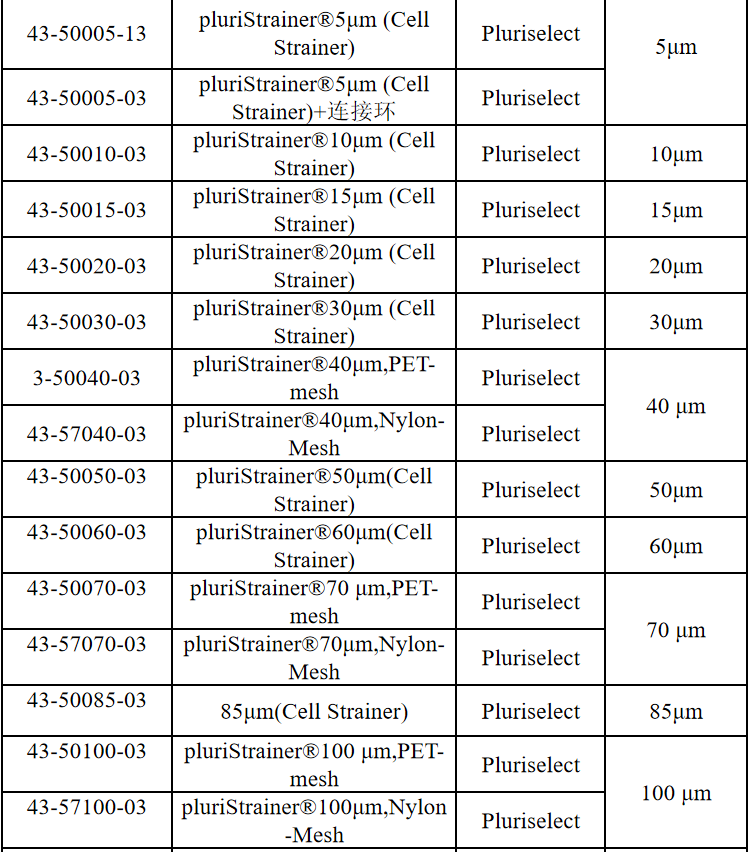

其他细胞品类
别划走,精彩继续

长按识别
添加一对一专属技术支持

扫码进群
咨询详细产品信息

点在看,传递你的品味












