【ScienCell】人气管成纤维细胞(HTrF)产品使用攻略
人气管成纤维细胞培养不成功、实验做不出来怎么办?新手小白迫切求助,希望各位前辈在文章下方留言,分享自己的经验,为小白们答疑解惑!
人气管成纤维细胞
(HTrF)
成纤维细胞负责结缔组织中大部分细胞外基质的合成,在伤口愈合中起主要作用。在气管中,成纤维细胞和上皮细胞相互作用,以应对组织损伤、细菌污染和其他环境因素。体内、外研究表明,气管成纤维细胞可通过影响上皮细胞增殖和分化促进气管上皮再生。HTrF的异常增殖可导致哮喘等气道疾病的发生。HTrF可作为有用工具用于阐明伤口愈合机制,并为组织再生提供新的见解。HTrF分离自人气管组织,其fibronectin特异性抗体免疫荧光染色呈阳性。
培养方式
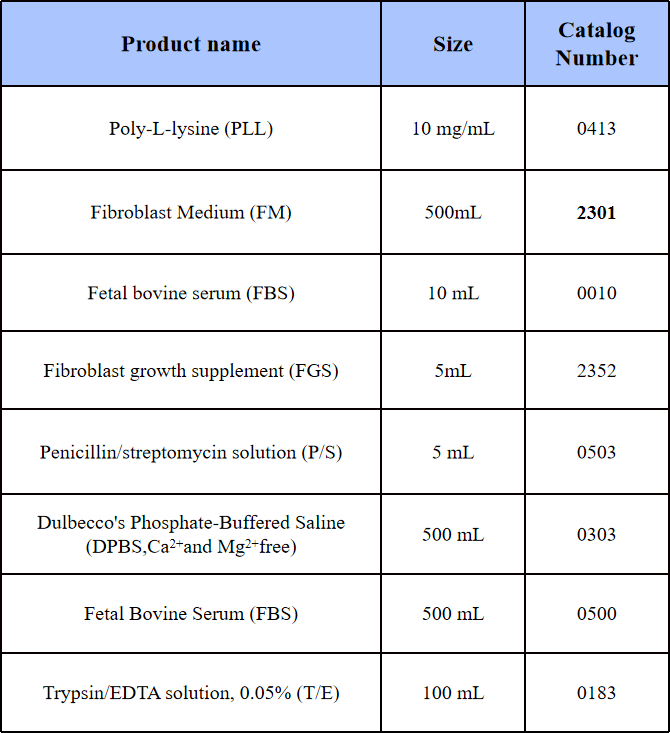
培养瓶:PLL(多聚-L-赖氨酸)包被的培养瓶。
培养基:HTrF用提供的FM完全培养基(包含基础培养基、2% FBS,1% FGS和1% P/S)培养。
操作步骤
1) 包被PLL(2 μg/cm2)培养瓶(T-75培养瓶)的准备:将10 mL无菌水加入到T-75培养瓶中,加入15 μL PLL原液,轻轻吹匀后将培养瓶放置在37°C的孵育箱中过夜(或至少1小时)。
2) 无菌水清洗包被PLL的T-75 2次,加入20 mL FM完全培养基(基础培养基、FBS、FGS和P/S按比例混合配制),将解冻后的HTrF加入至包被的T-75中,十字交叉法轻柔摇晃培养瓶使细胞分布均匀,将培养瓶放入细胞培养箱中。(注:不建议在解冻后稀释和离心细胞,因为这些操作对细胞的伤害比培养中残留的二甲基亚砜(DMSO)的影响更大。同时,细胞在PLL包被培养瓶中有助于促进细胞附着。)
换液:为了获得最佳结果,在培养开始后至少16小时内不要干扰培养。第二天更换培养基,以去除残留的二甲基亚砜和未附着的细胞,之后每隔三天更换一次培养基,直到培养达到约70%的密度,一旦培养达到约70%的密度,每隔一天更换一次培养基,直到培养达到约90%的密度。
传代:当细胞密度达到95%时进行传代。
1) 将T/E、包被培养瓶、DPBS、培养基提前置于室温平衡(不建议37℃加热)。
2) 弃除旧培养基,并用DPBS清洗细胞后吸除加入5 mL DPBS和5 mL 0.05% T/E solution 轻柔晃动培养瓶后放入37℃培养箱(注:原代细胞传代时请勿使用未稀释的胰蛋白酶),一段时间后镜下观察,待细胞完全变圆、脱落,轻轻拍打底部和侧面,加入2 mL FBS终止消化,将细胞悬液转移至15 mL离心管中,1000 rpm离心5 min,用新培养基重悬细胞沉淀后计数,根据5000 cells/cm2的密度传代至预先用PLL包被的培养瓶中。
生长条件
在CO2浓度为5%,温度为37℃,相对湿度(RH)为95%的细胞培养箱中培养。
表 1 HTrF培养材料
参考文献
[1] Evan M, Fanucchi M, Van Winkle L, Baker G, Murphy A, Nishio S, Sannes P, Plopper C. (2002) “Fibroblast growth factor-2 during postnatal development of tracheal basement membrane zone.” Am J Physiol Lung Cell Mol Physiol. 283(6): L1263-1270.
[2] Kobayashi K, Nomoto Y, Suzuki T, Tada Y, Miyake M, Hazama A, Kanemaru S, Nakamura T, Omori K. (2006) “Effect of fibroblasts on tracheal epithelial regeneration in vitro.” Tissue Eng. 12(9): 2619-2628.
[3] Goto Y, Noguchi Y, Nomura A, Sakamoto T, Ishii Y, Bitoh S, Picton C, Fujita Y, Watanabe T, Hasegawa S, Uchida Y. (2002) “In vitro reconstitution of the tracheal epithelium.” Am J Respir Cell Mol Biol. 20(2): 312-318.
其他细胞品类
别划走,精彩继续

长按识别
添加一对一专属技术支持

扫码进群
咨询详细产品信息

点在看,传递你的品味












