【Serumwerk】细胞和组织中纯化:从细胞和组织中纯化脂筏(lipid raft)(洗涤剂法)
从细胞和组织中纯化脂筏不成功、实验做不出来怎么办?新手小白迫切求助,希望各位前辈在文章下方留言,分享自己的经验,为小白们答疑解惑!
溶液制备
A. OptiPrep™
B. 分离培养基:150 mM NaCl, 5 mM二硫苏糖醇(DTT), 5 mM EDTA, 25 mM TrisHCl, pH 7.4辅以蛋白酶抑制剂
C. Triton X - 100
D. 溶液B + 1% (w/v) Triton X100
E. 磷酸盐缓冲盐水(PBS)
试验方法
在0-4℃的条件下进行所有操作。
从总细胞裂解液中分离出来的细胞
1. 用PBS洗涤单层细胞两次,并刮入此培养基中。
2. 将细胞制成颗粒,重悬于0.2 ml D溶液中;然后在冰上放置30分钟。
从核后上清液中分离
1. 在溶液B中匀浆细胞并将匀浆以1000 g离心10 min。
2. 将上清液调整为1% Triton X-100并在冰上放置30分钟。
梯度分离
1. 将2体积OptiPrep™添加到1体积匀浆或1000 g上清液中。
2. 用D溶液稀释OptiPrep™,给予35%,30%,25%和20% (w/v)碘克沙醇。
3.在管中为摇桶转子层各0.6 ml样品,将4种梯度溶液和溶液D填充管中。
4. 以160,000 gav离心4小时。
5. 从顶部界面收集脂筏或获取等体积分数的梯度,并根据需要进行分析。
方法注释
均质化介质和梯度溶液
如果在没有去污剂的情况下对细胞进行均质化,则可根据组织或细胞类型定制均质化培养基。一种含有NaCl, EDTA和缓冲液的培养基可能是最受欢迎的分离筏,但也有变化。例如,Oliferenko使用的DTT水平是1 mM而不是5 mM, EDTA被省略。一些与脂筏结合的蛋白质表现出Ca2+ -依赖性,因此纳入螯合剂可能不利于本研究。可省略DTT并且Triton X-100的浓度可低至0.1%和高至2%。有时,不连续梯度中的去污剂水平低于样品层中。CHAPS或Brij可代替Triton X100作为洗涤剂。蛋白酶抑制剂如PMSF、白细胞肽素、抗疼痛药、抑肽酶等应包括在方案B和D中
均质化
为了在清洗剂存在下实现细胞完全溶解,可能需要用一些机械手段进行补充,例如通过注射器针头重复通过。如果在添加去污剂之前对细胞进行均质化,则使用针对细胞(或组织)类型量身定制的均质化方案。Potter-Elevhjem组织匀浆和Dounce细胞匀浆曾经是标准程序。然而,对于细胞,通过27或25号注射器针头传代5-15次,有时在此之前进行Dounce匀浆,是更常见的。滚珠轴承均质器(“细胞裂解器”)现在被广泛认为是最有效和可重复的设备之一。理想情况下,该操作应尽可能温和且可重复,目的是在不损伤主要细胞器(尤其是细胞核)的情况下,至少造成95%的细胞破坏,因为在加入去剂之前,这些细胞器要从匀浆中去除。
形成不连续的梯度
不连续的梯度通常最容易通过底层(即低密度优先)使用1毫升注射器和长金属套管制备;使用注射器或巴斯德吸管覆盖小体积比较困难。一种替代方法是使用小体积(低脉动)蠕动泵;首先,将所需体积的溶液送入所附的管道,然后,反向流动,以便将其缓慢地排出到离心管中密度更大的一层。如果有必要,调整所有的体积比例,以便根据制造商的说明正确填充管。
梯度和离心条件
在不连续梯度的细节上有很大的变化;有时是比较简单的三层梯度(包括密集的样品),有时可能多达6层。后者更有可能提供不同洗涤剂抗性域的解析。就目前所知,最佳离心时间和RCF尚未被彻底研究。Oliferenko等人在略低的RCF (120,000gav)下使用了较长的离心时间(12小时)。由于转子的沉淀路径长度相对较短,在较高的RCF下4小时可能是令人满意的,但离心条件可能会随制备方式而变化,有证据表明,在相对低的g力(10万g)下,推荐较长的离心时间(12小时)以获得最佳分辨率。
梯度分析
根据所需的分辨率,使用自动移液管采集4或5个大区域的梯度可能就足够了。另外,为了获得更高的分辨率,应该通过导管穿刺、向上移位或自动从半月板抽吸来去除梯度。经常检查在梯度中的筏和非筏标记的分布,以确认离心已经取得了令人满意的筏的分辨率和回收率。
相关产品推荐
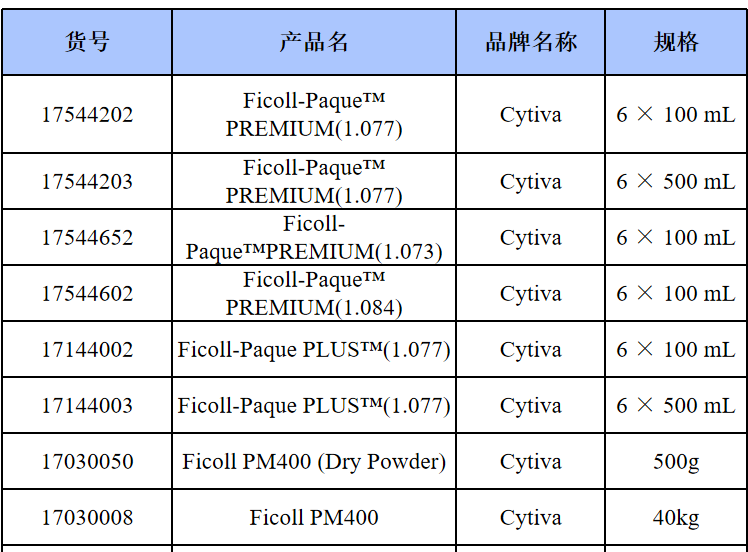
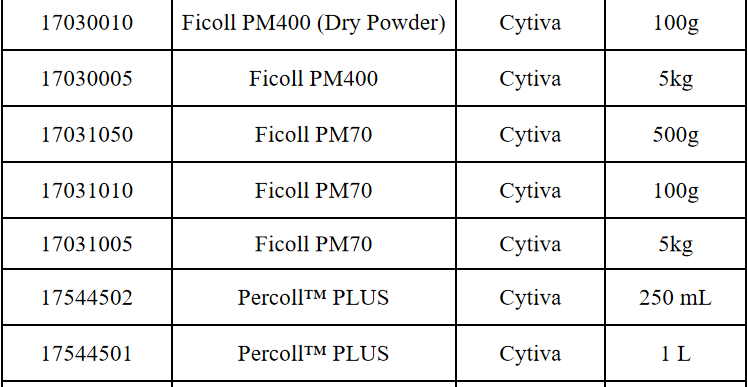
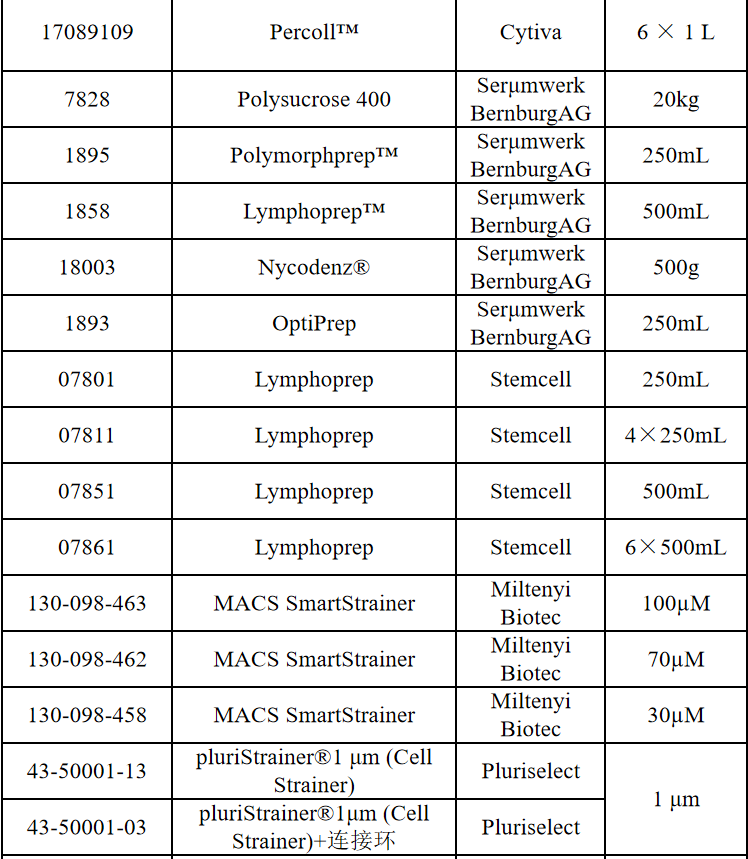

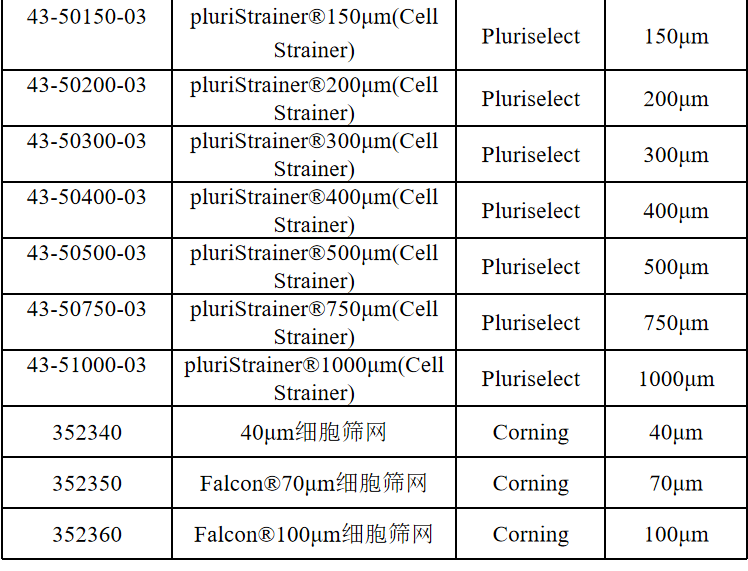
其他细胞品类
别划走,精彩继续

长按识别
添加一对一专属技术支持

扫码进群
咨询详细产品信息

点在看,传递你的品味












