【Serumwerk】乙型肝炎病毒(Hepatitis B virus)纯化
乙型肝炎病毒纯化不成功、实验做不出来怎么办?新手小白迫切求助,希望各位前辈在文章下方留言,分享自己的经验,为小白们答疑解惑!
Kock等人使用了10-50% (w/v)的Nycodenz梯度(固体Nycodenz溶解于140 mM NaCl, 1.5 mM MgCl2, 50 mM Tris-HCl, pH 8.0含0.5% NP40的等渗溶液中)。在25万g,20℃下离心40分钟(在贝克曼TLS55摇斗转子中)。梯度分析显示病毒DNA与鸭乙型肝炎病毒核心蛋白沉积在一起。在相同的离心条件下,该方法适用于碘克沙醇的不连续梯度(10%增量),并应用于哺乳动物培养细胞中生长的人乙型肝炎病毒。密度范围在两种情况下几乎是相同的,但是,虽然Nycodenz梯度的密集区域是高渗的,但整个碘克沙醇梯度或多或少是等渗的。这是否对病毒的条带密度有影响尚不清楚。
10-50% (w/v)碘克沙醇梯度有效地证明了与HBV pol相互作用的宿主因子(DDX3)被整合到核衣壳中,并且这依赖于HBV- pol。核心蛋白在梯度下降的四分之三处显示出一个峰带。这相当于35% (w/v)碘克沙醇或1.19克/毫升。同一组还显示Pol掺入核衣壳是蛋白酶k抗性的。
Bardens等人使用了一种完全不同的梯度格式,将细胞在含1 mM MgCl2, 10 mM Tris-HCl, pH 7.5(无去污剂)的低渗培养基中进行匀浆,在初始低速离心以去除细胞碎片后,将上清液调整为40% (w/v)碘克沙醇并覆盖28% (w/v)碘克沙醇溶液,在100,000 g离心3h。病毒颗粒可能围绕在两种碘克沙醇溶液之间的界面上。
唯一报道鸭HBV分析的论文是关于抑制HBV复制的。细胞在常规培养基(0.25 M蔗糖,1 mM EDTA, 60 mM HEPES-NaOH, pH 7.4)中均质化,该培养基常用于膜分离研究。将任何未匀浆的细胞和部分破坏的细胞在100 g下沉淀4 min;颗粒经两次洗涤后在同一培养基中再次均质;所有上清液都聚集在一起。以2,500 g制备核后+重线粒体上清液10 min(洗涤颗粒并将上清液合并)。将该上清液加载至5、10、15、20、25和30% (w/v)碘克沙醇的不连续梯度上。使用均质缓冲液从OptiPrep™的稀释制备这些溶液。将梯度材料在288,000 g下离心2 h (Beckman SW41Ti转子)。
它们被用来研究阳离子肽Deca-(精氨酸)8处理细胞的效果,Deca-(精氨酸)8已被证明具有显著的抗病毒活性。Abdul等证明,DNA、核衣壳和preS/S蛋白在梯度底部的条带相当宽(ρ = 1.14/1.22 g/ml),尽管一些衣壳和preS/S的条带密度略低。Deca-(arg)8处理后,DNA和核心蛋白的密度明显降低,而preS/S蛋白的密度明显升高。因此,梯度似乎提供了这些大分子的高分辨率分析。
相关产品推荐
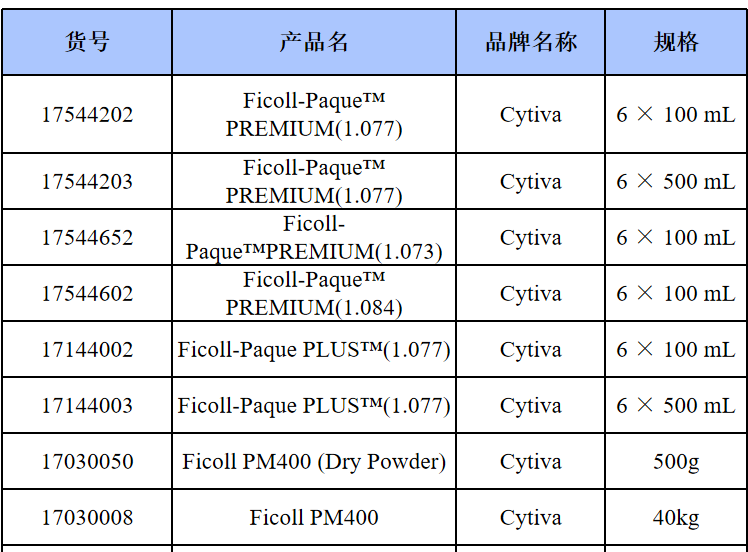
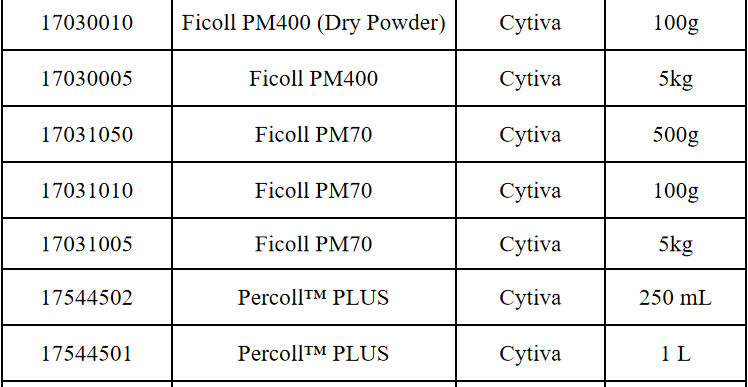
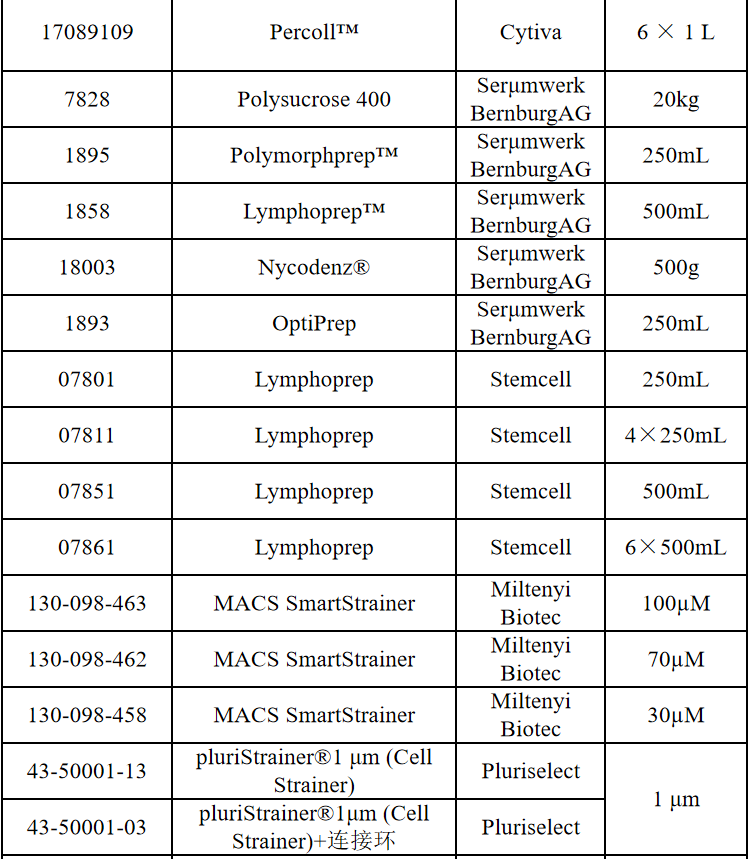
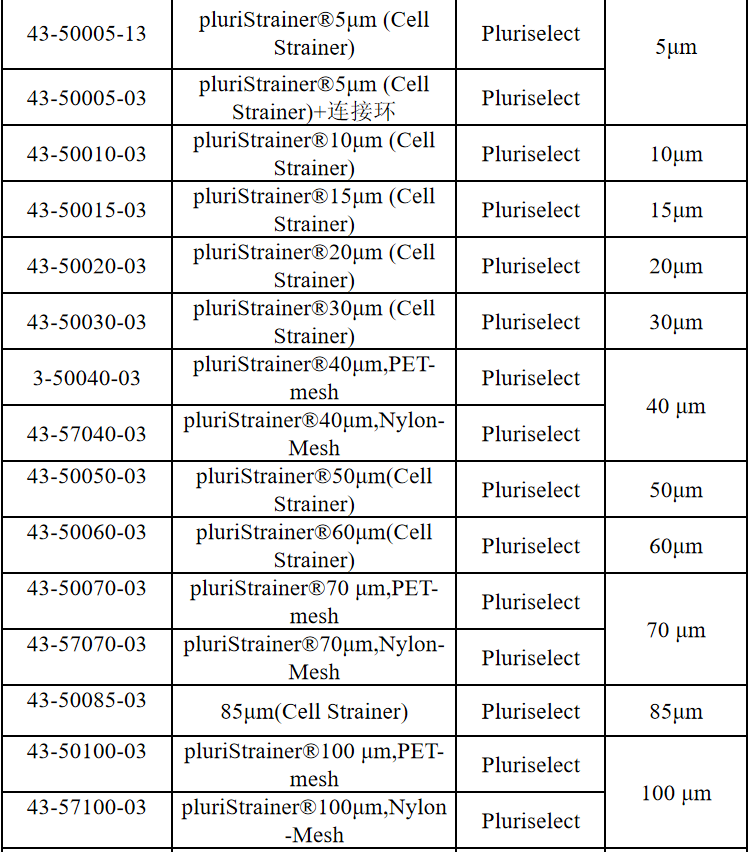
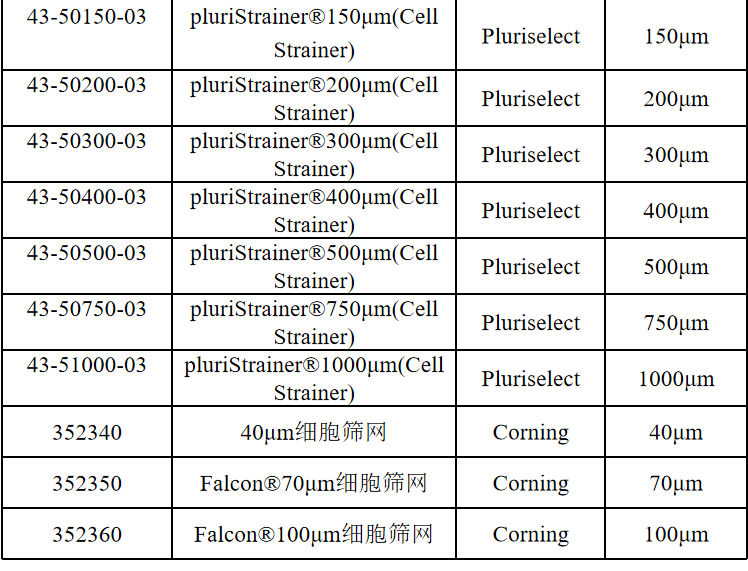
其他细胞品类
别划走,精彩继续

长按识别
添加一对一专属技术支持

扫码进群
咨询详细产品信息

点在看,传递你的品味












