【Serumwerk】刷状边缘和基底外侧质膜域的分离
刷状边缘和基底外侧质膜域的分离不成功、实验做不出来怎么办?新手小白迫切求助,希望各位前辈在文章下方留言,分享自己的经验,为小白们答疑解惑!
从肠(回肠)黏膜中获得
溶液制备
A. OptiPrep™
B. 均质缓冲液:2 mM DTT, 1 mM EGTA/1.006 mM CaCl₂,20 mM Tris-HCl, pH 7.5
C. OptiPrep™稀释缓冲液:150 mM NaCl, 50 mM NaF, 20 mM Hepes-NaOH, pH 7.2
试验方法
请在0 ~ 4℃进行除步骤1外的所有操作。
1.根据需要,将回肠段在37℃气体林格碳酸氢盐缓冲液中孵育。
2.将切片放在冷冻的玻璃板上,用玻片轻轻地刮去黏膜。
3.将粘膜转移到一个小烧杯中,倒入10体积的溶液B,并置于冰中。
4.使用Polytron™均质器进行均质,使用10 × 10秒的爆发,每个爆发间隔20秒的休息。在休息期间,将烧杯中的内容物在冰中旋转,以确保有效的冷却。
5.将匀浆3000 g离心5 min,将未破碎的细胞、细胞核和碎片打成颗粒。
6.仔细地倒入上清液,重复离心。
7.将步骤6的上清液以160,000 g离心1 h。在离心期间实施步骤8和步骤9。
8.用溶液C稀释OptiPrep™,制备10%、12.5%、15%、17.5%、20%、22.5%、25%、27.5%和30% (w/v)碘克沙醇溶液。
9.使用注射器和金属套管层将1.25 ml的每种溶液装入用于摆动桶转子的管子中。
10.在溶液C中重新悬浮来自步骤7的颗粒并约层。在每个梯度的顶部放置1.3 ml,以填充管。
11.大约64,000 gav离心90分钟;允许转子在没有刹车的情况下减速或使用缓慢减速程序。
12.使用向上位移、管穿刺或从半月板抽吸来卸载约0.6 ml的梯度。
方法注释
均质介质和梯度溶液
其他蛋白酶抑制剂可由操作者酌情包括在溶液B和C中。用溶液C稀释OptiPrep™来制备密度梯度溶液意味着NaCl、NaF和Hepes的浓度将随着碘克沙醇浓度的增加而降低。如果认为不需要,则首先用1体积的溶液稀释5体积的OptiPrep™,其中含有150 mM NaCl, 300 mM NaF, 120 mM Hepes-NaOH, pH 7.2,然后用溶液C稀释这50% (w/v)碘克沙醇工作溶液,以制备密度梯度溶液。NaF和Hepes浓度将在整个梯度中保持恒定。如果OptiPrep™稀释剂也含有6×150 mM NaCl,那么所有密度溶液将严重高渗,这可能是不可取的。其他均质化介质也已被使用:Scalera等使用0.25 M蔗糖,10 mM Tris-乙醇胺- HCl, pH 7.6的简单介质。
密度梯度
建立
使用注射器(1-2 ml)和长金属套管进行底层(即低密度优先)通常最容易制备不连续梯度;使用注射器或巴斯德吸管覆盖小体积比较困难。另一种替代方案是使用小体积(低脉动)蠕动泵。首先,将所需体积的溶液送入所附的管道,然后,反向流动,以便将其缓慢地排出到离心管中密度更大的一层。
管填充物
在摆斗转子中,不同管体积的转子按比例放大或缩小体积。在该方案中实现的分离可能至少部分基于沉降速度,因此样品体积不应超过梯度体积的10%。如果有必要,调整所有的体积比例,以便根据制造商的说明正确填充管。
梯度分析
以蔗糖酶为标记物鉴定顶端结构域,以Na+/K+ ATP酶为基底外侧结构域;EEA1被用作早期核内体标志物。Li等证明了钠氢交换体(NH3)定位于顶端结构域和早期内体。最近丝氨酸/苏氨酸激酶Akt也主要定位于顶端结构域。梯度也已用于Caco-2细胞膜的分馏;这种梯度可能适用于从其他组织和细胞中分离出基底外侧和顶端的质膜结构域,但这只能通过实验来确定。
从肾皮质组织和肾小球(狭缝横膈膜)中获得
肾脏上皮
一、溶液制备
A. OptiPrep™
B. OptiPrep™稀释缓冲液:0.25 M蔗糖,120 mM Tricine-NaOH, pH 7.8
C. 50%碘克沙醇工作液:5体积的OptiPrep™与1体积的溶液B混合。
D. 匀浆缓冲液:0.25 M蔗糖,20 mM Tricine-NaOH, pH 7.8
E. 梯度溶液:用溶液D稀释溶液C,制备含5%、15%和25% (w/v)碘克沙醇的溶液
二、试验方法
在0-4℃下执行所有操作。
1.醇溶液(10-20 mg蛋白/ml)中。
2.使用双腔梯度发生器或gradient Master™制备线性的15-25%碘克沙醇梯度(12-13 ml),然后将约0.5 ml微粒悬浮液层在顶部以填充管。
3.10万g离心3小时,通过导管穿刺、从半月板抽吸或向上移位收集梯度,0.5-1.0 ml /次。
三、方法注释
均质介质和梯度溶液
根据操作者的决定,蛋白酶抑制剂可包括在溶液B和D中。如所述的工作溶液的制备,确保缓冲液的浓度在整个梯度中是恒定的。如果认为这一点不重要,则可通过使用溶液D稀释OptiPrep™来制备5%、15%和25%碘克沙醇溶液。
密度梯度
如果这两种装置都不具备,则通过使不连续的碘克沙醇扩散形成连续的碘克沙醇梯度。如果有必要,调整所有的体积比例,以便根据制造商的说明正确填充管。
梯度分析
微域标记的两个主要领域已被确定;一个靠近梯度顶部的窄带包含典型的微绒毛标记,如绒毛蛋白和Na-Pi共转运蛋白NaPi-2。在梯度的中间是较宽的条带,它高度富集于钠/H+交换体NH3,这只是包含绒毛蛋白的条带的一个非常小的组成部分。Megalin(和网格蛋白)存在于这两个区域。含NH3的中位条带被鉴定为微绒毛间微结构域,之后被证明在肌球蛋白VI中高度富集。有趣的是,绒毛蛋白在梯度中位区域的分布与肌球蛋白的分布不同。这一数据表明,碘克沙醇的15%-25% (w/v)梯度较浅(覆盖密度范围为1.10 ~ 1.14 g/ml),可用于其他组织的血浆结构域分辨。最近megalin在刷状缘处理,处理Na+/H+交换体;二肽基肽酶IV抑制剂下调其表达,并降低自发性高血压率已有报道。对IIc型钠碘交换器的研究也使用了相同的方法。
肾小球
由Yeaman、Vogelmann和Nelson开发的由三碘克沙醇层不连续梯度产生的自生成梯度也被用于分析来自肾小球的连接蛋白。将来自肾小球匀浆的PNS部分与OptiPrep™混合,调整为30% (w/v)碘克沙醇,并覆盖等体积的20%和10%碘克沙醇。自有梯度通常运行在垂直或近乎垂直的转子,因为有效的转子和一个短的沉积形成路径长度是必需的,但Fukasawa等用贝克曼SW60 Ti(4毫升管)在350000 g的3 h。但是知道在缺乏垂直或接近垂直转子,如果使用两层开始格式(而不是统一iodixanol浓度),可以生成有效的梯度,例如,10毫升固定角度转子。梯度显示出较强的分辨能力,如occludin、cadherins、claudin-5和crumbs-3在梯度上的分布非常独特。
相关产品推荐
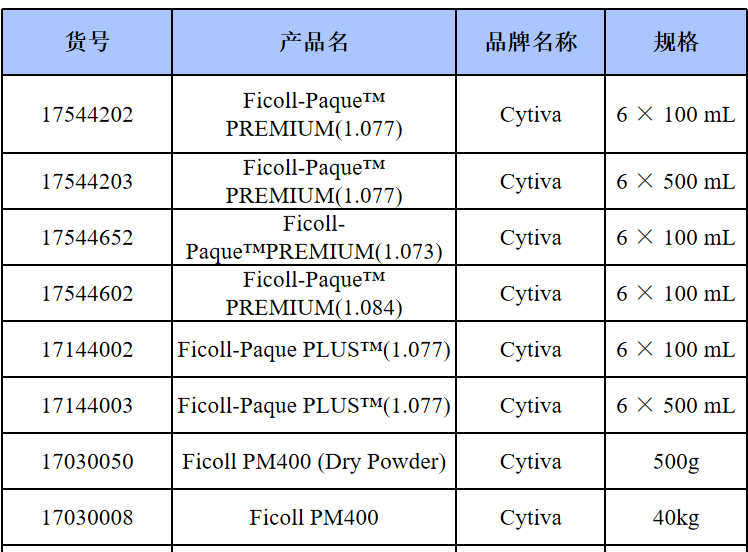
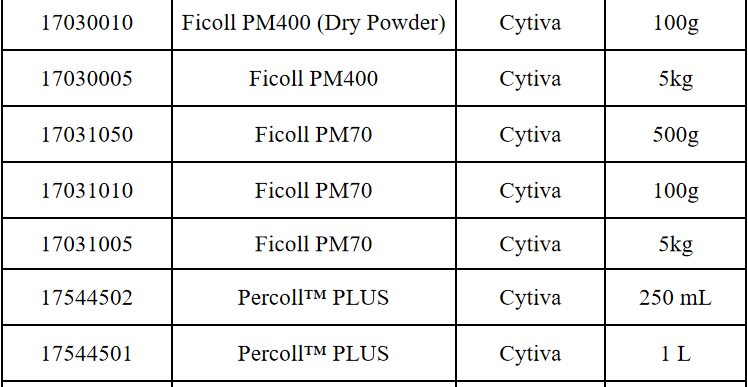
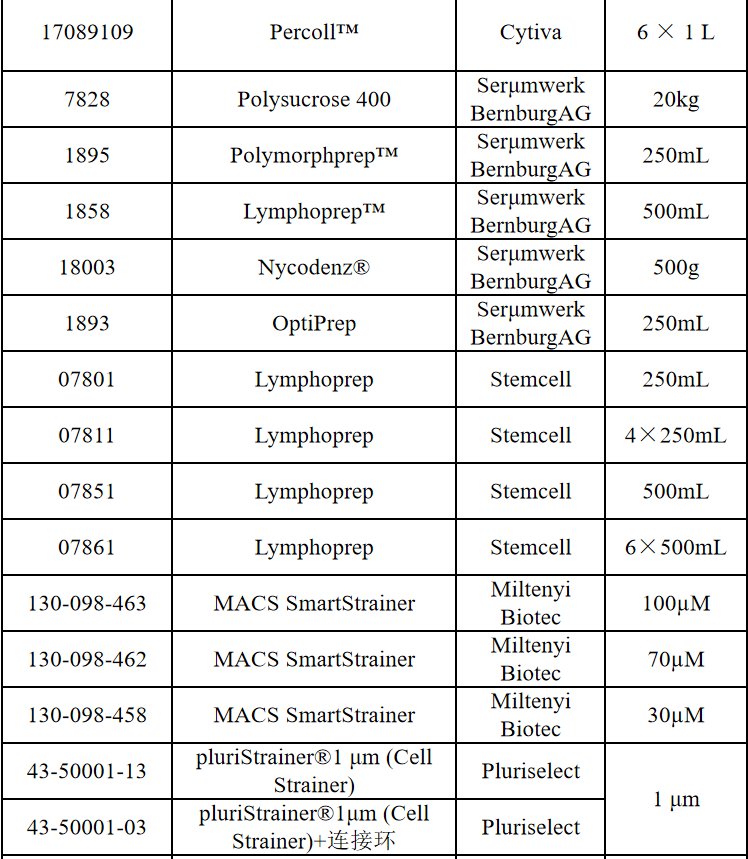
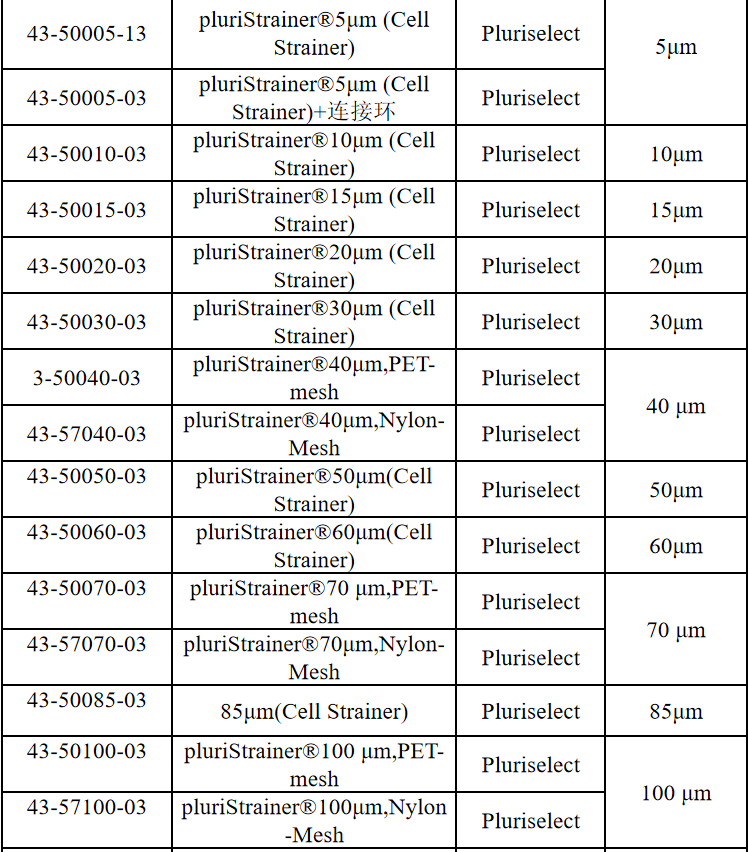
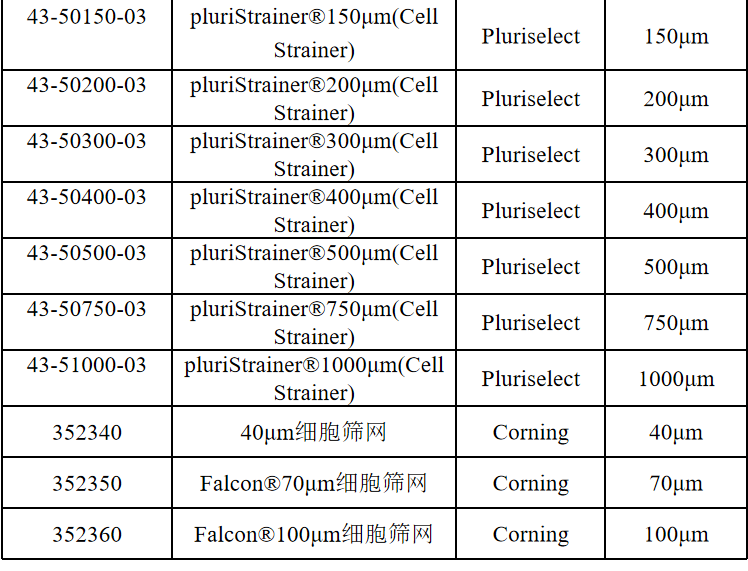
其他细胞品类
别划走,精彩继续

长按识别
添加一对一专属技术支持

扫码进群
咨询详细产品信息

点在看,传递你的品味












