【Serumwerk】细胞和组织中纯化:单层细胞均质化(Cell homogenization in monolayers)
单层细胞均质化不成功、实验做不出来怎么办?新手小白迫切求助,希望各位前辈在文章下方留言,分享自己的经验,为小白们答疑解惑!
使用等渗介质
溶液制备
A. 磷酸盐缓冲盐水(PBS)
B. 0.25M蔗糖,10 mM三乙醇胺-10 mM乙酸,pH 7.8(用三乙醇胺或乙酸调整到正确的pH,而不是用HCl或NaOH)
C. 溶液B含1mm EDTA
试验方法
1.使用接近融合的单层。
2.去除介质并用溶液A(在室温下)冲洗单层至少三次。然后用溶液B(同样在室温下)洗涤单层至少两次。
3.向培养皿中加入冰冷的溶液C(对于9厘米的培养皿,大约2毫升),用橡皮淀帚将细胞刮到培养基中。不要尝试制造单细胞悬液。
4.将重悬的单层细胞转移到有冰的烧杯中,如果需要,再用1ml溶液C清洗盘子,以回收剩余的细胞。重复这个步骤。
5.如果体积太大,离心细胞,然后用体积更小的溶液C重新悬浮颗粒。同样,不要尝试制造单个细胞悬液。
6.使用紧密的Dounce匀浆器的舂杵进行10-25次匀浆。在相差显微镜下观察10次后的悬浮液。继续均质化直到约90%的细胞破碎。
7.缓冲液是该方法成功的关键,没有替代物是令人满意的。
替代低渗均质介质
溶液制备
A. 15mM KCl, 1.5 mM醋酸镁,(MgOAc) 1 mM二硫苏糖醇(DTT), 10 mM Hepes-KOH, pH 7.5。
B. 375mM KCl, 22.5 mM MgOAc, 1mM DTT, 220 mM Hepes-KOH, pH 7.5
C. Hepes缓冲盐水(HBS)。
试验方法
1.在溶液C中洗涤细胞两次,以去除所有培养基。
2.将细胞悬浮于10 ml溶液A中,并在冰上膨胀10分钟。
3.将细胞离心并去除足够的上清液以留下相当于细胞颗粒3.5倍的体积。
4.在紧密配合的Dounce均质器中均质,然后加入溶液B体积的1/5。
培养基的离子成分倾向于避免细胞骨架蛋白形成任何“凝胶”,通过在小体积内均质化,被释放的细胞器受到细胞溶质蛋白的保护,免受低渗休克。
相关产品推荐
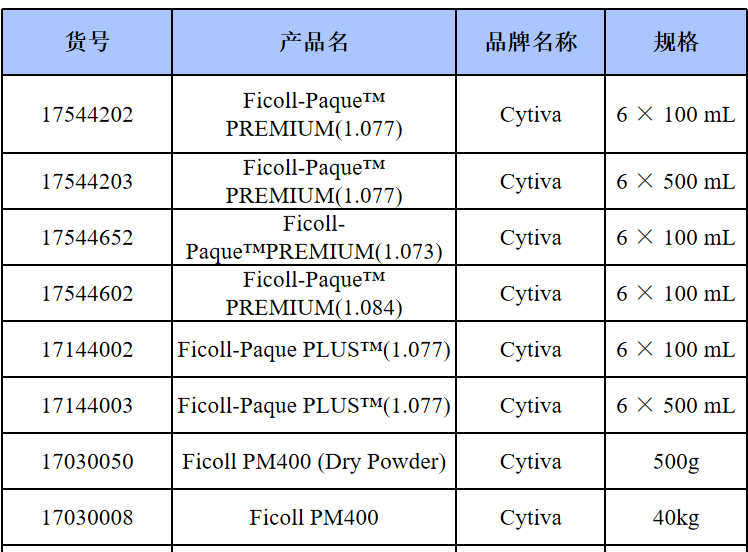
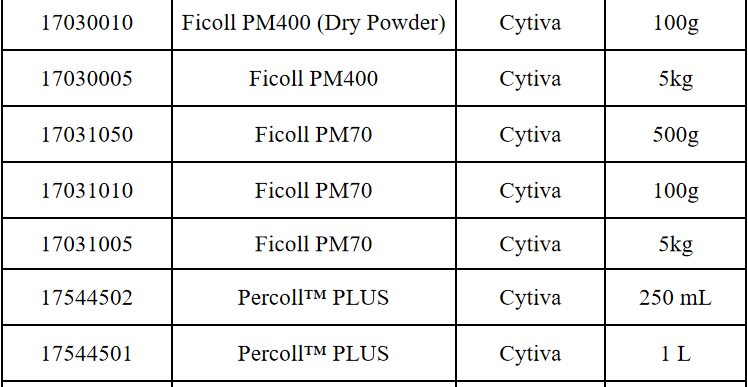
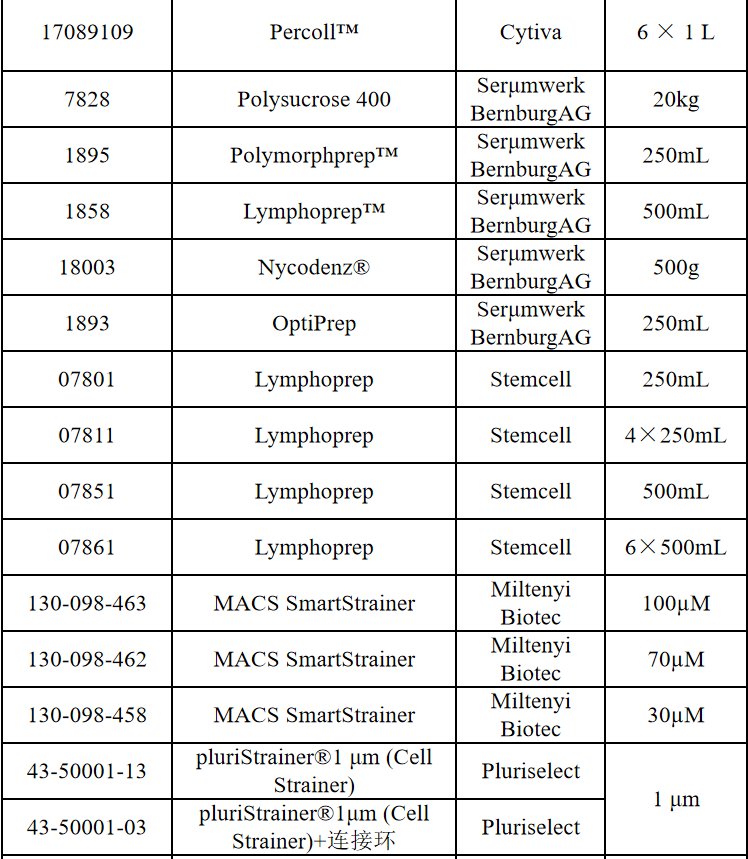
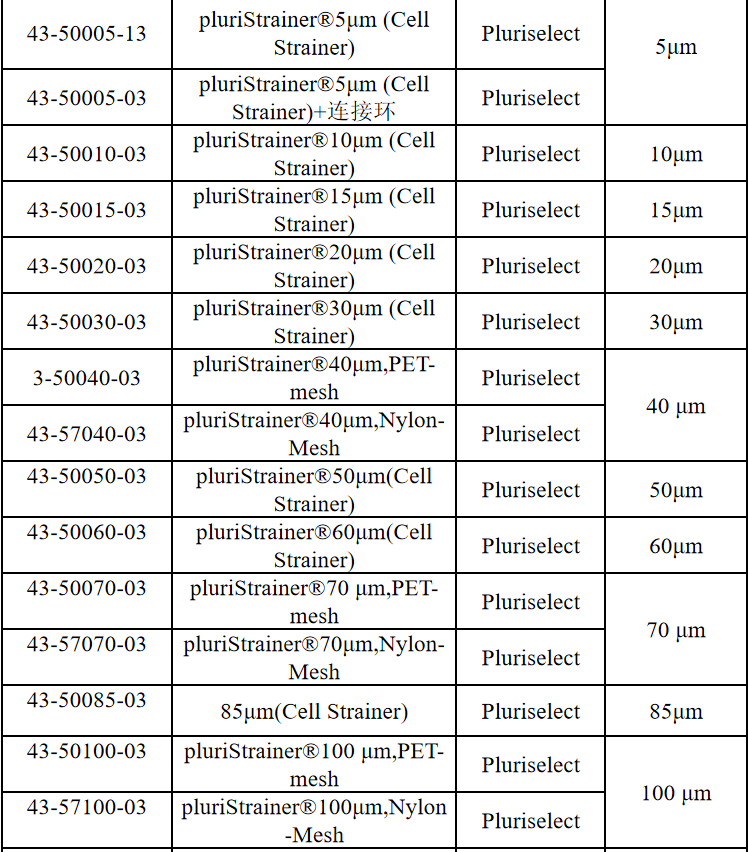
其他细胞品类
别划走,精彩继续

长按识别
添加一对一专属技术支持

扫码进群
咨询详细产品信息

点在看,传递你的品味












