【Serumwerk】自生成梯度中的细胞膜运输和细胞内信号传导的分析
自生成梯度中的细胞膜运输和细胞内信号传导的分析不成功、实验做不出来怎么办?新手小白迫切求助,希望各位前辈在文章下方留言,分享自己的经验,为小白们答疑解惑!
溶液制备
A. OptiPrep™
B. 均质化培养基:0.25 M 蔗糖, 1 mM EDTA, 20 mM Hepes-NaOH, pH 7.4
C. 稀释液: 0.25 M蔗糖, 6 mM EDTA, 120 mM Hepes-NaOH, pH 7.4 (可选)
D. 工作溶液 (50%, w/v iodixanol):将5体积溶液A与1体积溶液C混合(可选)
试验方法
遵循在37℃执行的任何代谢标记步骤;在0-4℃下执行所有后续操作。
1.在溶液B中洗涤细胞2 - 3次,以去除任何培养基(在均质化之前,清除所有培养/孵育培养基的痕迹是重要的)。
2.将细胞悬浮于溶液B中,并在Dounce匀浆器中通过细注射器针头(22-g)重复传代或在“细胞裂解器”中匀浆。
3.将匀浆1000 g离心10 min,使细胞核和细胞碎片成球。
4.将1000g上清液以27,000 gmax在固定角度的转子中离心15分钟,使所有主要细胞器和大部分高密度微粒体成球。
5.以235,000 gmax离心27,000 g上清以使低密度微粒体(LDM)成球。
6.在溶液B中重新悬浮LDM,并与溶液D或OptiPrep™充分混合,以得到适当的碘克沙醇浓度,例如14%或30 w/v。
7.将4-5 ml转移到密封管中,用于近垂直或垂直转子,以265,000 gav离心4小时。
8.允许转子减速使用控制减速程序或关闭制动器在2000转。
9.通过试管穿刺,用致密液体向上移位或从半月板抽吸,从Beckman Optiseal™试管中收集梯度。
方法注释
均质介质和梯度溶液
通常必须将均质培养基裁剪成组织或细胞类型并且不知道HM的组成是否与分离相关。介绍了有机渗透平衡剂如蔗糖、甘露醇和山梨醇在亚细胞膜功能研究中的相容性;此外,这些低离子强度的HMs和梯度溶液允许直接使用馏分进行SDS-PAGE。使用OptiPrep™应用表中描述的方案类型的所有已发表的方法都使用了0.25 M蔗糖缓冲液与Tris, Hepes, Tricine或三乙醇胺(10-20 mM浓度),并且通常(但不总是)含有1 mM EDTA。
用无机盐补充HM变得越来越常见,可以减少离子相互作用,膜之间的聚集,并对抗任何由于细胞骨架蛋白引起的匀浆粘度的提高。一些不含蔗糖的培养基完全使用氯化钠或氯化钾或两者作为主要的渗透平衡剂。HM的组成也应与任何后续分析过程兼容。二价阳离子的加入可以防止核破裂;一般稳定膜,但可能导致聚集。
可选的碘克沙醇工作溶液含有与均质介质相同浓度的EDTA和缓冲液,当其密度升高时,这些浓度可在LDM悬浮液中保持。如果认为这一点不重要,可通过与OptiPrep™混合(如在原始方法中使用)来提高密度。
可根据操作者的判断将蛋白酶抑制剂包括在溶液B和C中。
均质化
均质化方案应根据细胞(或组织)类型量身定制。Potter-Elevhjem或Dounce组织匀浆和Dounce细胞匀浆曾经是标准程序。然而,对于细胞来说,通过注射器针头(标号(G)从21到25不等)进行12-20次传代,有时在此之前进行Dounce匀浆,已经变得非常常见。滚珠轴承均质器(“细胞裂解器”)现在被广泛认为是最有效和可重复的设备之一。
理想情况下,操作应尽可能温和和可重复,目的是造成至少95%的细胞破坏,而不破坏主要细胞器,特别是细胞核和溶酶体。均质化过程的类型和严重程度将对细胞器的完整性和细胞质中由管状结构产生的囊泡的大小产生影响。因此,膜带在任何后续梯度中的模式可能不容易预测。
LDM部分之制备
1000g的离心可以省略,但以低速去除细胞核和细胞碎片可能会增强稍后较小的较低密度颗粒的回收。如果源材料是组织(例如骨骼肌)或来自组织的原代细胞,LDM通常是通过通过0.4/1.5M蔗糖梯度离心10000g上清液来制备。
自生成梯度形成
通过调节碘克沙醇的起始浓度和离心时间,可以提高不同密度囊泡的分辨率;14%或30% (w/v)碘克沙醇和1或4 h分别是两个常用的起始浓度和离心时间,但这些应根据经验进行修改。
如果使用垂直转子,可能需要包括一个小的20%碘克沙醇缓冲液,以防止任何密集的污染物到达管壁。在一个接近垂直的旋翼中,这没有问题。
分析
用抗GLUT4, TfR, sortilin, VAMP2和Rab4的抗体对梯度组分进行免疫印迹显示,14%碘克沙醇形成的梯度能够精细区分复杂的胞内体- TGN系统。在4 h梯度中,至少可以检测到两组含有GLUT4的囊泡,与TGN或核内体标记物一致。
然而,这种梯度的密集区域的陡峭性质不允许同时分辨密集的囊泡。例如,从这14%的碘克沙醇梯度可以看出两个包含GLUT4的囊泡群体,但尚不完全清楚磷脂酰肌醇激酶PIKfyve和P85 PI3K是否完全局限于较致密的膜室。另一方面,30%碘克沙醇形成的梯度不仅可以完全溶解内小体- TGN标志物中的激酶,还可以部分溶解含有两种类型激酶的囊泡。磷酸化ser-p40被发现与PIKfyve共分馏,而再循环蛋白IRAP主要在低密度的部分被检测到。
使用14%碘克沙醇起始浓度,Maier和Gould将Beckman TLN100转子的离心时间缩短至1小时,并能够识别出密度较大的部分为GLUT4储存囊泡(GSV),其GLUT4对短期胰岛素刺激有显著反应。低密度分数与TGN和核内体标记物相一致,这些标记物也富含半胱氨酸串蛋白Csp-1。此外,Syntaxin STX16靶向GSV,而STX6靶向TNG/核内体。Yeh等人和Liu等人在GLUT4转运研究中也使用了标准的14%碘克沙醇起始浓度和分别离心4小时和2.5小时的时间。Ma等人使用了与Liu等人大致相似的方法,证明了胰岛素产生的氧化应激将GLUT4导向溶酶体。
Ikonomov采用了同样的自生成梯度系统来证明驱动蛋白接头JLP与PIKfyve相互作用,并且这两种蛋白及其结合在基于微管而非微管的内小体到TGN的货物运输中是必需的。Chen利用自生成的梯度系统研究COS细胞胞质分裂前囊泡向中心体运输的Exocyst调节,在该系统中,他们观察到RalA与TfR和Rab11共带,而不是与早期内体,高尔基体或细胞质标记被Landry应用到293T细胞,以识别梯度中的TGN,顺式高尔基体和再循环内体(RE),并研究RE向高尔基体的运输。Xie等人也使用了一个自产生的梯度来研究GLUT4插入质膜的过程。
Karunanithi等人使用确定的14% (w/v)碘克沙醇起始浓度发现了调节GLUT4转运的G蛋白级联。同样的梯度公式也表明VAMP2对GLUT4转运也有重要影响。
相关产品推荐
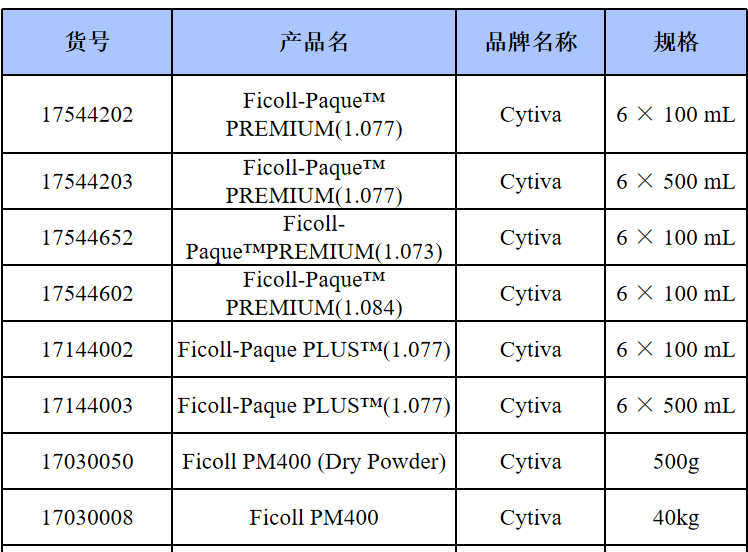
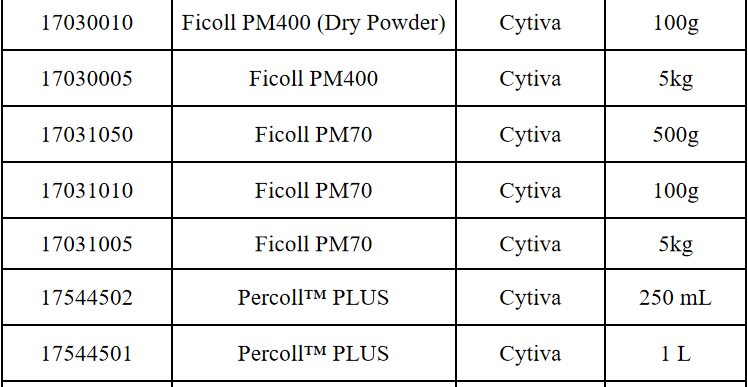
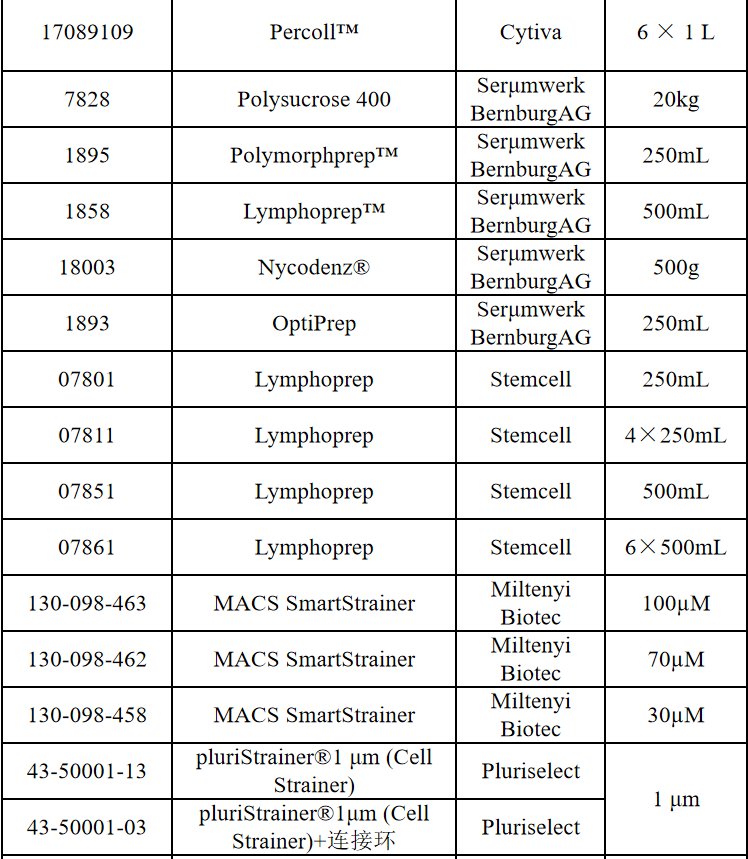
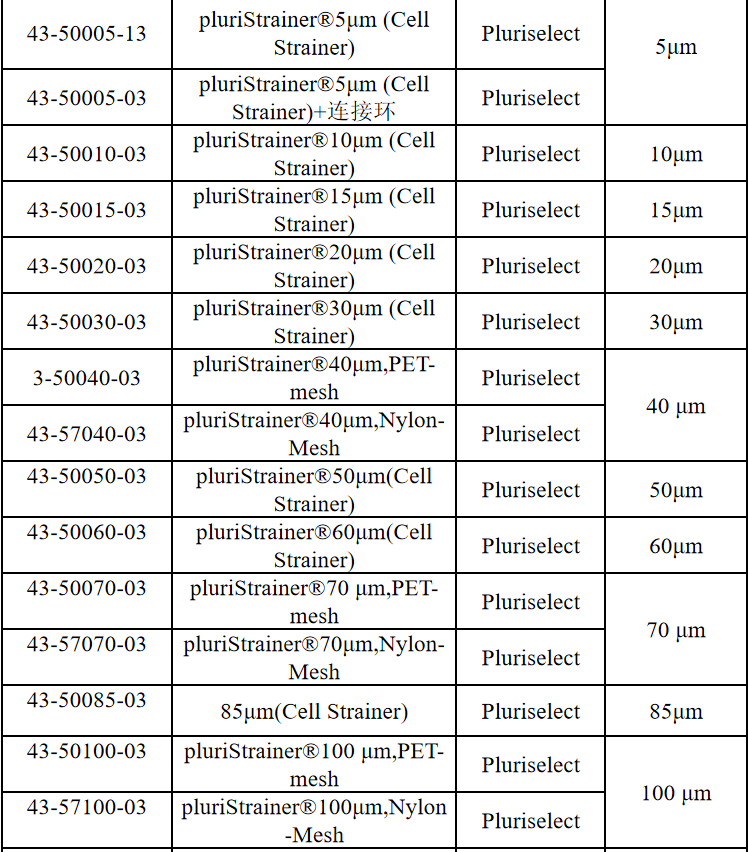
其他细胞品类
别划走,精彩继续

长按识别
添加一对一专属技术支持

扫码进群
咨询详细产品信息

点在看,传递你的品味












