【Serumwerk】溶酶体(lysosome)分离——连续梯度
溶酶体分离不成功、实验做不出来怎么办?新手小白迫切求助,希望各位前辈在文章下方留言,分享自己的经验,为小白们答疑解惑!
溶液制备
A. OptiPrep™
B. 均质培养基:0.25 M蔗糖,1 mM EDTA, 20 mM HEPES-NaOH, pH 7.4
C. OptiPrep™稀释剂:0.25 M蔗糖,2 mM EDTA, 40 mM HEPES-NaOH, pH 7.4
D. 30% (w/v)碘克沙醇工作溶液:混合等体积溶液A和C
根据需要添加蛋白酶抑制剂。
本文所述溶液可能不适用于所研究的细胞或组织类型;它们可能被认为是最初为大鼠肝脏设计的“传统方法”,但可能不适合某一特定细胞类型或研究。
人子宫颈癌传代细胞(HeLa cells)分离
将LMF加载于由4、10、16和24% (w/v)碘克沙醇层形成的连续梯度上,并在20,000 g下离心17 h。线粒体和溶酶体标记物的分布有明显的区别,尽管这两种细胞器的分离可能在跨越较高密度范围的较浅梯度中得到增强。最佳密度范围亦可系细胞或组织特异性。15-30% (w/v)碘克沙醇也用于HeLa细胞。
破骨细胞(Osteoclasts)分离
所选密度范围也可为研究目的和细胞类型的函数。将来自成骨细胞的核后上清液(PNS)加载到0-17% (w/v)碘克沙醇梯度上,并在大约150000 g离心100min。更不寻常的是,这是在一个固定角度的转子中进行的,但只要在离心管中梯度的重新定位过程中,从2000转/分钟到2000转/分钟的加速度是缓慢而平稳地进行的,没有明显的原因为什么这样的转子不能使用。这种梯度将较轻的质膜与较密的溶酶体完全分离。
人皮肤纤维瘤(Human skin fibroma)分离
采用5 ~ 20% (w/v)碘克沙醇梯度,90000 g离心20 h,用于分离人皮肤成纤维细胞中的ER和溶酶体。这些梯度和离心条件最初由Sugii描述用于研究CHO细胞系的内吞作用。Sugii评论说Percoll梯度不能从核内体分离质膜,而在碘克沙醇梯度中,Na+/K+- ATP酶与EEA1, Rab9和syntaxin 6区域完全分离,每个区域都显示出独特的梯度带模式。该梯度也用于HeLa细胞。
小鼠大脑(Mouse brain)分离
匀浆以150mm NaCl为主要渗透压平衡剂,在1mm EDTA, 1mm EGTA, 10mm Tris-HCl, pH 7.4,含1% Triton X-100。在培养基中加入去污剂是一种克服髓鞘问题的脑特异性策略。梯度完全溶解来自质膜的溶酶体+晚期核内体。
HEK细胞分离
原来的7.5-25% (w/v)碘克沙醇梯度被修改为11-22%的梯度,以最大限度地分离溶酶体和ER,以表明成熟和未成熟形式的α- n -乙酰半乳糖胺酶分别定位于溶酶体和ER。
原发性人成纤维细胞(Primary human fibroblasts)分离
采用10-30% (w/v)碘克沙醇梯度和40%碘克沙醇缓冲垫,顶部负载LMF,在垂直转子中以55,000 gav离心90分钟,完全分离溶酶体、线粒体和过氧化物酶体,但较轻的ER重叠在溶酶体上。很难评估较长的离心时间是否能更有效地分解内质网和线粒体。
●使用类似的连续碘克沙醇梯度分离的其他细胞的溶酶体是MDCK细胞,HepG2细胞和家蚕丝腺。
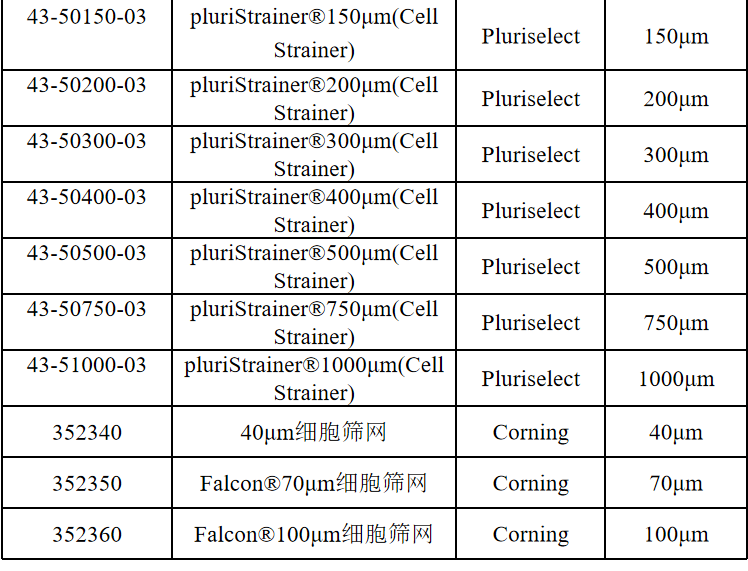
相关产品推荐
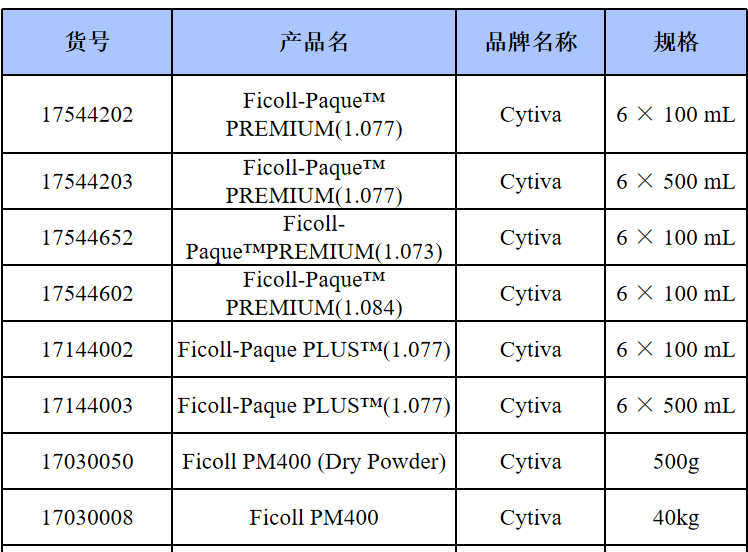
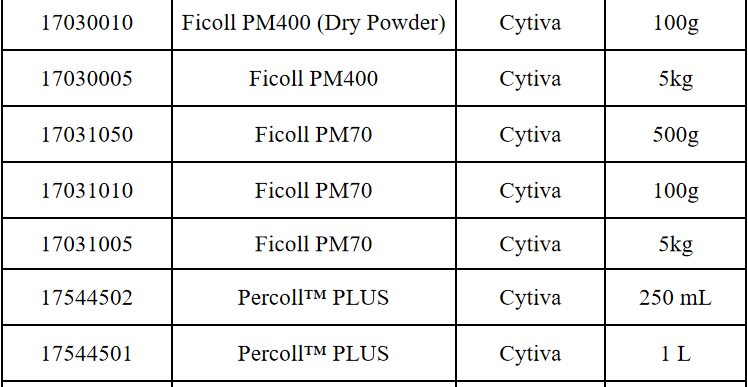
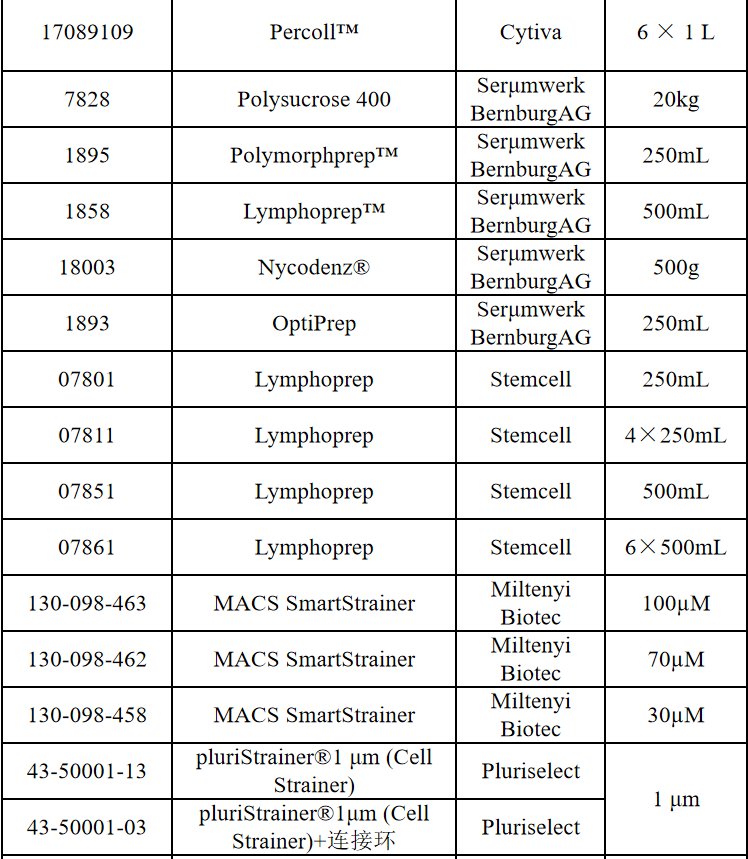
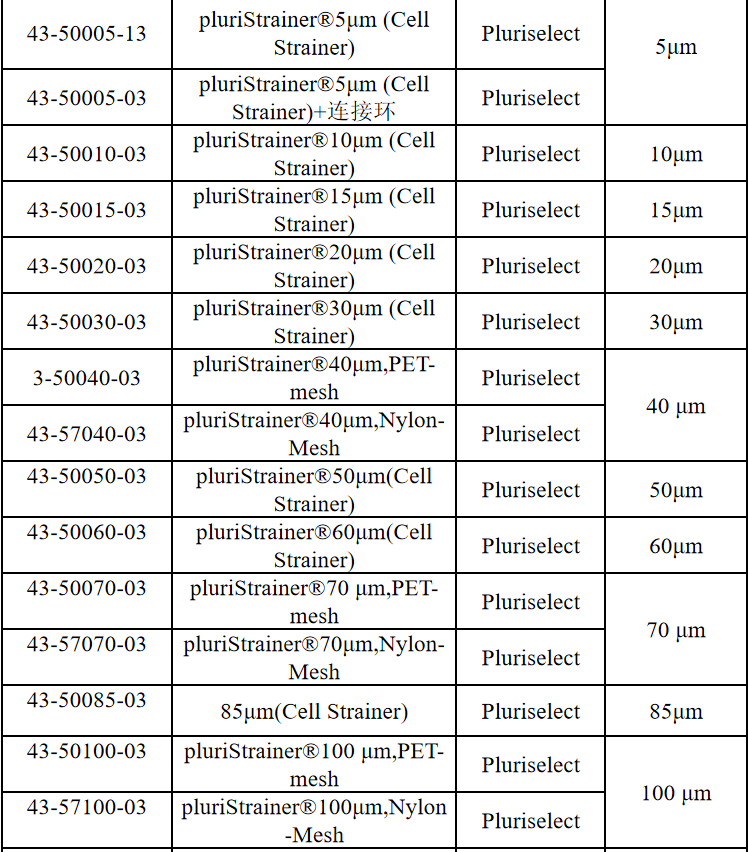
其他细胞品类
别划走,精彩继续

长按识别
添加一对一专属技术支持

扫码进群
咨询详细产品信息

点在看,传递你的品味












