【Serumwerk】光线粒体组分纯化分析(线粒体、溶酶体和过氧化物酶体)——在不连续碘克沙醇梯度中纯化
光线粒体组分纯化不成功、实验做不出来怎么办?新手小白迫切求助,希望各位前辈在文章下方留言,分享自己的经验,为小白们答疑解惑!
溶液制备
A. OptiPrep™(60% w/v碘克沙醇)
B.均质培养基:0.25 M蔗糖,1 mM EDTA, 20 mM Hepes-NaOH, pH 7.4。
C.稀释剂:0.25 M蔗糖,6 mM EDTA, 120 mM Hepes-NaOH, pH 7.4。
D. 50%碘克沙醇工作溶液(ρ = 1.272 g/ml):溶液A 5 体积+溶液C 1体积
可根据操作者的判断包括蛋白酶抑制剂。
粗线粒体部分制备
所有的解决方案和所有的操作都保持在0-4℃。
1.肝脏或其他组织:用剪刀(或组织斩刀)将组织切碎,并用溶液B(每2.5 g组织使用10 ml培养基)转移到Potter-Elvehjem(特氟龙和玻璃)匀浆器中。使用杵的大约6次行程(500-700转/分)均质化。
2.细胞:1-3×10⁸细胞用5 ml磷酸盐缓冲盐水洗涤,再用5 ml溶液B洗涤。将细胞悬浮于3 ml溶液B中,在滚珠均质器中使用5次均质,或在紧密连接的Dounce均质器(惠顿a型)中使用研磨棒20次均质。
3.将匀浆在固定角度的转子中以1000gav离心10分钟,使细胞核成球。
4.抽吸并保留上清液。
5.在溶液B中使用松装Dounce均质器的舂杵轻轻敲击2-3次,将颗粒轻轻再次均质并且重复离心。
6.合并上清液并在10-17000 gav下离心10-15分钟,产生粗制重质+轻质线粒体部分。
7.使用宽松的(惠顿B型)Dounce匀浆器(杵的2-3次敲击)将该颗粒重新悬浮在2.0-3.0 ml溶液B中。
底部和中部梯度
对于底部梯度,通过与溶液D(分别为1.4体积 + 3.6体积)混合,将从步骤7的粗馏份调整为36% (w/v)碘克沙醇(1.204 g/ml)。在某些情况下,可将样品调整为较高密度,例如44% (w/v)碘克沙醇。在大约14 ml的试管层中,放置4.0-4.5 ml的悬浮液,并覆盖每种4.5 ml的梯度溶液:1.079和1.175 g/ml;1.10和1.16 g/ml或1.127和1.150 g/ml ;后者用于小鼠脊髓。来自KB-V1和MCF7细胞的线粒体也已以1.079- 1.175 g/ml的格式纯化。
对于中部梯度,将从步骤7的粗馏份调整为25-30% (w/v)碘克沙醇,并在36% (w/v)碘克沙醇与一种低密度溶液之间分层。梯度可以在顶部用可选的1-2 ml均质介质完成。这有利于收集最低密度的材料。在大约50,000 g离心3-4小时。使用一个缓慢减速程序或允许转子从2000 rpm减速,没有刹车。
对于体积较大的粗线粒体组分,在其他转子(36 ~ 38 ml管)中,体积应按比例增大。
收集位于上界面上方的线粒体,或者收集1 ml的梯度,低密度端先向上移动,或者密集端先在管的底部小心地引入一个狭窄的金属套管(连接到蠕动泵)。
到目前为止,碘克沙醇对任何酶没有明显的抑制作用。用于测定细胞器酶标记的标准分光光度法(在340 nm以上进行)可以直接在梯度组分上进行。蛋白质也可以通过任何基于考马斯亮蓝的方法直接测定。如果需要去除梯度介质,可以用等体积的缓冲液稀释馏分;以约30,000gav制粒10分钟并重新悬浮于合适的缓冲液中。
1.127和1.150 g/ml格式的在1.127 g/ml层的顶部与下一个界面的线粒体产生了特别好的分离。
上层梯度
10、15、20、25和30% (w/v)碘克沙醇的多步骤梯度在100,000 g离心3 h后,对大鼠肝核后上清液中的几个膜区室(质膜、高尔基体、内质网+溶酶体和线粒体+过氧化物酶体)提供了极好的分辨率。线粒体+过氧化物酶体部分在第二个梯度(20%、25%、30%和35%碘克沙醇)上重新运行。在相同条件下离心使这些细胞器完全溶解。
心脏单核细胞线粒体通常在6% (v/v) Percoll®和17%和35% (w/v)碘克沙醇的复合不连续梯度上纯化,以50,000 g离心30 min。两种碘克沙醇溶液界面处的线粒体带。尚不清楚Percoll®层是否可由相同密度(约1.04 g/ml或3%碘克沙醇)。
脑线粒体:最近isinger等人报道了使用自由流电泳作为去除脑线粒体突触体污染的最佳方法,作者建议使用垂直转子中的顶部负载不连续梯度运行来制备线粒体。用5 mM HEPES-KOH、1 mM EDTA、2 mM PMSF、1 mM DTT、1 mM ε-氨基己酸、pH 7.4的低渗培养基稀释OptiPrep™制备梯度溶液。我们用0.25 M含蔗糖的常规缓冲液稀释梯度溶液制备。在Beckman VTi50垂直转子管中,分别装入3 ml 25%、10 ml 21%、13 ml 14.5%和4 ml 8.5% (w/v)碘克沙醇;粗制的线粒体悬浮液被装载在顶部,以填充管。转子在33,000 g离心约35分钟。线粒体带靠近管的底部。
补充方法
从脊髓物质中去除髓鞘
如果线粒体污染是一个严重的问题,一个简单的短自旋密度屏障离心可能是有用的。Parone等人从脊髓核后上清液中悬浮12000 g - 10 min的颗粒,加入12%碘克沙醇,210 mM甘露醇,70 mM蔗糖,1 mM EDTA, 10 mM Tris-HCl, pH 7.2中,在17000 g离心10 min。顶部的髓磷脂层从细胞器颗粒中分离。
细胞同源性
由于使用含有EDTA的匀浆培养基可能使细胞核不稳定,因此,首先在150 mM MgCl₂,10 mM KCl, 20 mM HEPES pH 7.4中匀浆HEK细胞;将其调整为8.5% (w/v)蔗糖并在1000 g下10 min去除细胞核。将5000 g - 10 min的颗粒在相同的缓冲蔗糖/Mg/K培养基中洗涤一次,最后在常规缓冲蔗糖/EDTA溶液中重悬。
Bhowmick等人对猴肾细胞采用了一种有趣的方法,该方法避免了任何可能对线粒体造成潜在损害的剪切力。将细胞在1-2% (w/v) Triton X100、0.01- 0.03% Nonidet P40和0.4-0.6% CHAPS中冰上悬浮30 min。从核后上清液中制备7000 g - 10 min的颗粒,然后在梯度纯化前悬浮在常规的0.25 M蔗糖缓冲液中。
三层底部负载梯度
Choi等人首先使用的一种常用浮选格式,其中粗制的线粒体部分悬浮在36% (w/v)碘克沙醇中;覆盖30%和10%的溶液,并在约50,000 g离心4小时。溶液是通过OptiPrep™的匀浆缓冲液和10%/30%界面处的线粒体带稀释来制备的。这已被用于脑/脊髓,肾,骨肉瘤细胞和HEK细胞。在该格式的变体中,通过80,000 g离心3 h将样品层调整为50%碘克沙醇。Wood-Allum等开发了44%,25%和20%碘克沙醇的变体(也用于HEK细胞,猴肾细胞和神经母细胞瘤细胞);36%,25%,17.5%碘克沙醇梯度的肝脏和36%,25%,20%碘克沙醇梯度离心在100,000 g 4小时的HeLa细胞。最近,来自结肠癌细胞和淋巴瘤细胞的线粒体通过从覆盖30%和10%碘克沙醇的36% (w/v)碘克沙醇溶液中浮选纯化,80,000 g或50,000 g离心3 h。
在所有这些浮选梯度中,线粒体带在两个低密度碘克沙醇溶液之间的界面上,因此不严格要求在顶部有一层均质介质,但如果顶部带细胞器也要分析,应该包括在内。
上层梯度
来自神经母细胞瘤细胞和成纤维细胞的粗线粒体组分(含15%碘克沙醇,w/v),在30、27、23、20和17%碘克沙醇梯度上分层,在145,000 g离心4小时,从溶酶体(梯度顶部)分离线粒体(23-27%界面)。这种不连续的17%-30%碘克沙醇梯度(粗馏分在10%或15%碘克沙醇中)离心2 h,也被用于小鼠肝组织Caco-2细胞和内皮细胞。10、15、20、25、30%碘克沙醇,10万g离心1小时,同样的浓度梯度被用于HEK细胞、脑、肾、肝、心脏和骨骼肌。在这个梯度中,线粒体围绕在梯度的中点周围。
中层负载梯度
在对人外周血单个核细胞产生的PHA-blast细胞的细胞器进行分析时,Schmidt等使用了27%、22.5%、19%、16%、12%、8% (v/v) Optiprep™的不连续梯度,样品中位数加载在19% (v/v)层,并在150,000 g离心5小时。该梯度覆盖的密度范围比常规使用的低得多;这是否是特定细胞类型的要求尚不清楚。最低密度层和最高密度层相当于5%和16% (w/v)碘克沙醇。梯度法主要用于纯化分泌型溶酶体。
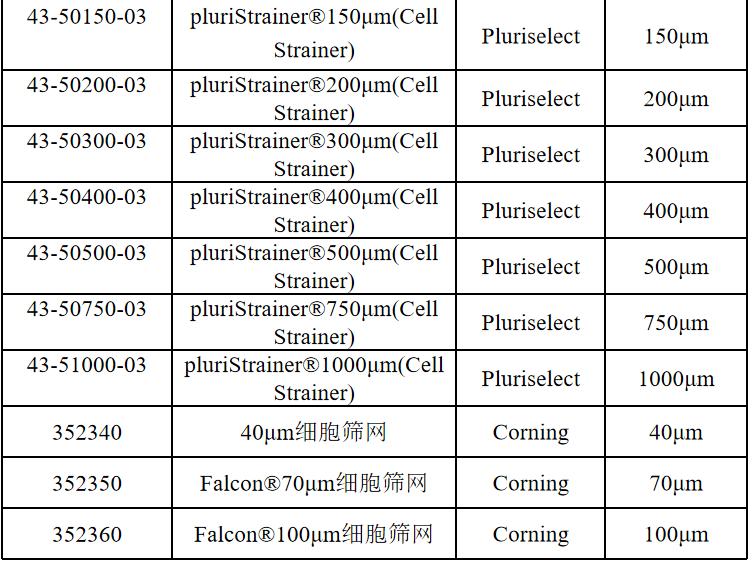
相关产品推荐
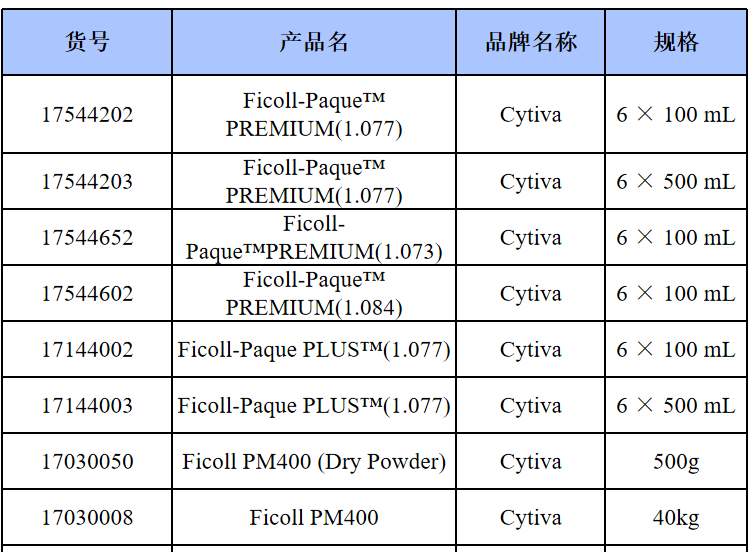
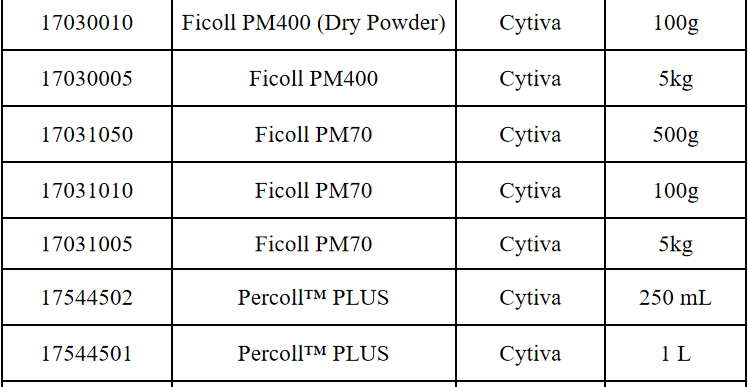
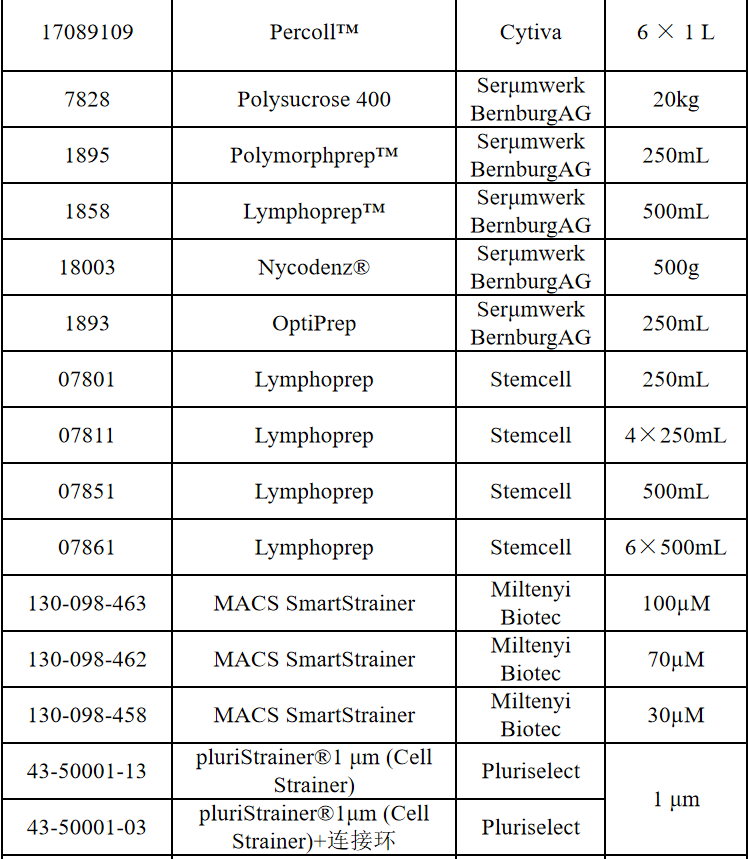
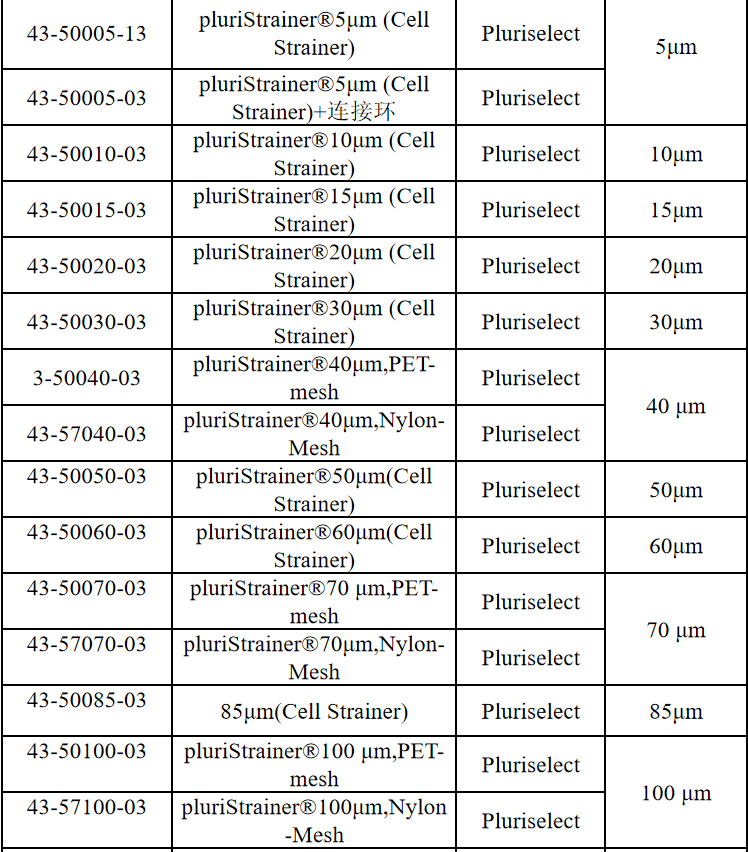
其他细胞品类
别划走,精彩继续

长按识别
添加一对一专属技术支持

扫码进群
咨询详细产品信息

点在看,传递你的品味












