【Serumwerk】组织中分离单核细胞(Hyaline leukocyte) 沉积到一个密度屏障上
组织中分离单核细胞不成功、实验做不出来怎么办?新手小白迫切求助,希望各位前辈在文章下方留言,分享自己的经验,为小白们答疑解惑!
沉积到一个密度屏障上
溶液制备
A. OptiPrep™(60%,不含碘二醇)-使用前轻轻摇瓶
B. 缓冲盐水
等渗屏障溶液
用溶液B稀释溶液A,得到密度较低的等渗溶液。可调节该屏障溶液之密度以提高单个核细胞之纯度或产量。已发表的方法引用的% (w/v)碘克沙醇浓度为12.6%,其密度约为1.072 g/ml,15%,其密度约为1.084 g/ml,也包括标准的1.077 g/ml屏障,对于肠细胞来说,在1700 g下使用密度更低的屏障(1.055 g/ml) 10 min。离心条件通常在600-1000 g范围内进行10-20 min。
低渗的1.077 g/ml屏障溶液
用水稀释溶液B(2.5体积+0.5体积),然后将2.7体积溶液A与9.3 体积稀释的盐水溶液混合。
试验方法
1.把2体积细胞悬浮液分层位于1体积密度屏障之上。
2.在室温下以750 g离心20 min。
3.允许转子在没有刹车的情况下减速,并从接口获取MCs。
在两层梯度中的沉积
溶液制备
A. OptiPrep™ (60%, w/v iodixanol)
B.培养基(RPMI 1640)
试验方法
1.使用前轻轻摇晃OptiPrep™
2.将溶液A和B分别按以下体积比(1:8 .8)和(1:3.5)配制成1.051和1.078 g/ml两种溶液。
3.将细胞悬浮于1.051 g/ml溶液中,并在等体积的1.078 g/ml溶液上分层。
4.在室温下以750 g离心20 min。
5.允许转子在没有刹车的情况下减速,并从接口获取MCs
浮选策略
溶液制备
A. OptiPrep™ (60%, w/v iodixanol).
B. 培养基(RPMI 1640)保持Hepes(游离酸)或Tricine作为100 mM原液在4°C;Hepes(2.38g)或Tricine(1.79g)/ 100毫升水。溶液B: 0.85 g NaCl溶于50 ml水中;加入10 ml Hepes或Tricine原液;用1 M NaOH调整到pH 7.2-7.4,最大可达100 ml。
试验方法
1.使用前轻轻摇晃OptiPrep™,将4体积的溶液A与2体积的溶液B混合,制成密度为1.215 g/ml的溶液。
2.将细胞悬浮于3.9 ml溶液B中,与2.1 ml 1.215 g/ml溶液温和但充分混合。
3.将1 ml溶液B置于顶部并以1500 g在4℃下离心20 min。
4.允许转子在没有刹车的情况下减速,并从接口获取MCs。
方法注释
1.该溶液等效于Optiprep 1.077并具有1.077 g/ml的密度和约265 mOsm的渗透压摩尔浓度。
2.样品的相对体积和密度势垒可能并不重要,但给定的比率被广泛使用。
3.等渗屏障上的分离应不依赖于温度,但由于在较低温度下粘度增加,较低温度可能需要进一步5分钟离心。低渗透介质的使用应在室温下进行,因为水在低温下通过渗透梯度的运动减少。
4.如果过多的Mc丢失到颗粒中,则可向上调整1.078 g/ml溶液的密度。Zellweger等使用1.052和1.076 g/ml的小肠和肝脏单个核细胞密度。
5.分离应不依赖于温度,但由于较低温度下粘度增加,较低温度可能需要进一步5分钟离心。
6.溶液A:溶液B的比率可根据关于MCs恢复的数据来调节。在步骤3中,可能将样品直接与OptiPrep混合,而不是与ρ = 1.215 g/ml介质混合;后者是选择的方法,因为OptiPrep与样品完全混合需要更剧烈的搅拌,这可能对细胞有害。
7.OptiPrep™在样品中的最终v/v比为22%,变化包括21%,21.5%和24%。因此,碘克沙醇的最终浓度从12.6% (w/v)到14.4% (w/v)不等,相当于大约的密度1.072 -1.082 g / ml。
8.样品上的小层培养基不会影响分离,但它阻止了MCs在气/液界面的条带,从而导致聚集问题。
9.为了从小鼠骨髓中分离单个核细胞,Mukai将单个核细胞从1.090 g/ml的密集样本层中漂浮,通过1.08 g/ml的样本层,使用100 g的非常温和的离心条件,离心20 min。
10.对于骨髓细胞,将30 ml细胞悬液与10.1 ml OptiPrep™和4 ml水混合;然后用5 ml PBS覆盖并在1000 g离心30 min -注意样品中的最终碘克沙醇浓度为13.7% (w/v)。
相关产品推荐
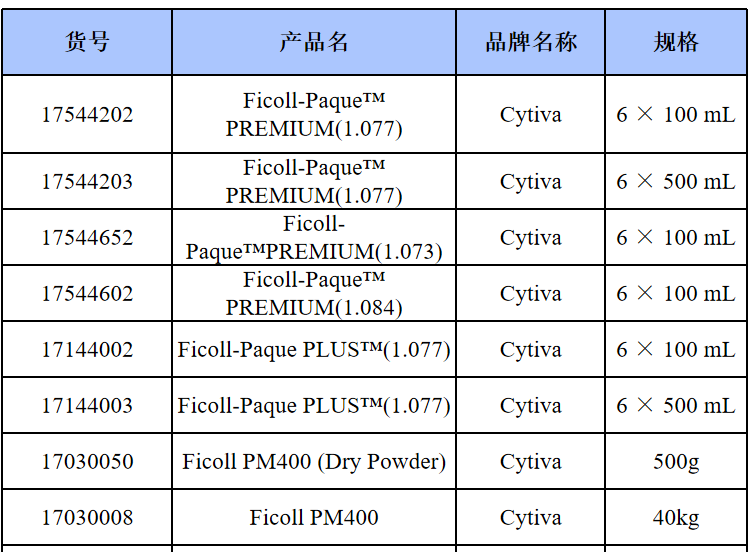
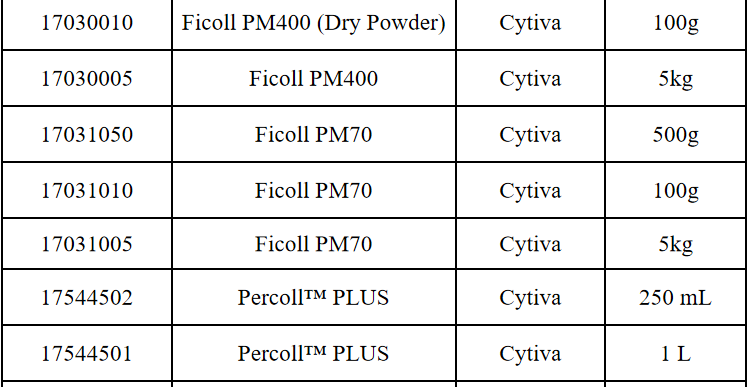

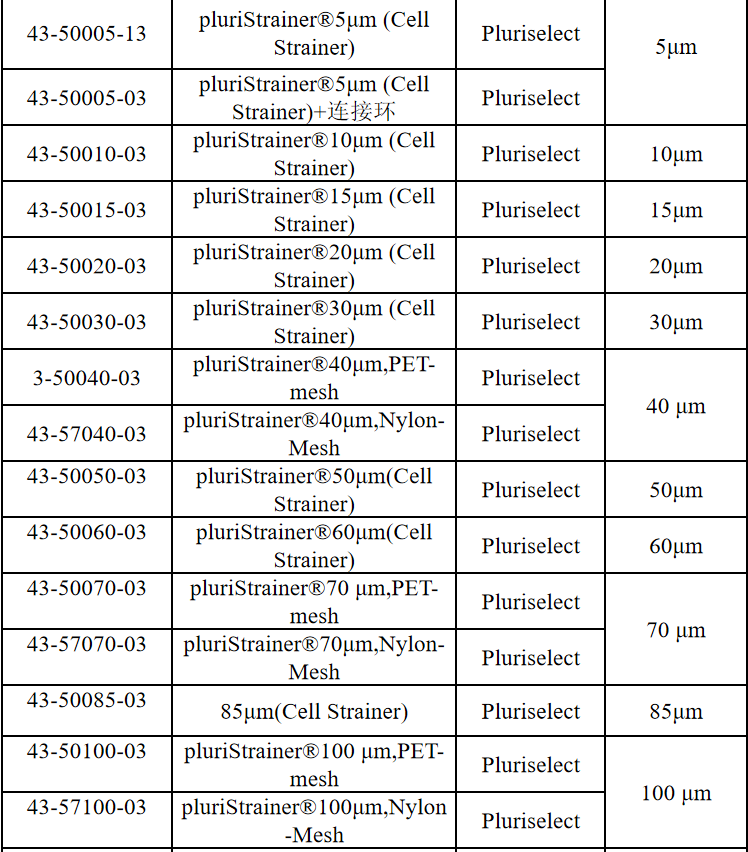
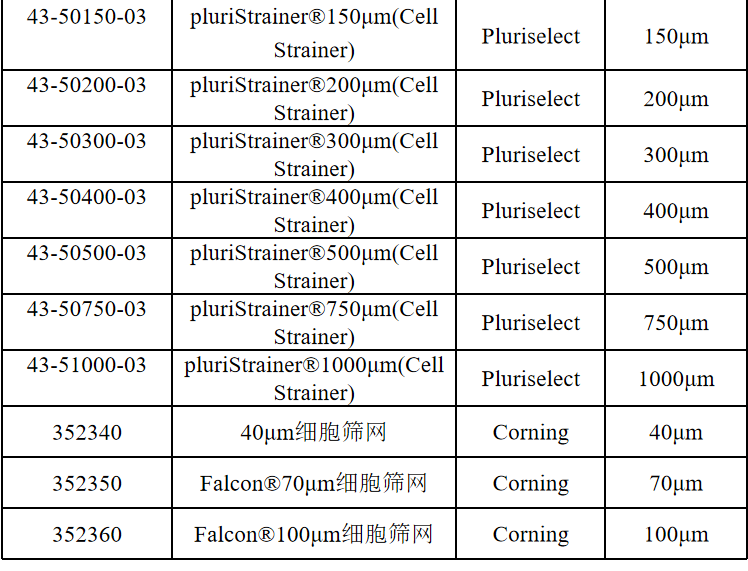
其他细胞品类
别划走,精彩继续

长按识别
添加一对一专属技术支持

扫码进群
咨询详细产品信息

点在看,传递你的品味












