【Serumwerk】富白细胞血浆中分离单核细胞(Hyaline leukocyte)——密度屏障
富白细胞血浆中分离单核细胞不成功、实验做不出来怎么办?新手小白迫切求助,希望各位前辈在文章下方留言,分享自己的经验,为小白们答疑解惑!
溶液制备
A. OptiPrep™(60%,不含碘二醇)-使用前轻轻摇瓶
B. 缓冲盐水(等渗):0.85%(w/v)氯化钠,10 mM三-NaOH,pH 7.0
C. 缓冲盐水:1.05%(w/v)氯化钠,10 mM Tricine-NaOH,pH 7.0
D. 多蔗糖:溶液B中的6%(w/v)多蔗糖(Mr=400-500x103)
试验方法
构成密度屏障
混合0.12体积的OptiPrep™0.48体积的溶液d。如果有渗透压计,检查密度屏障溶液的渗透压;其浓度为(335±10)mOsm,浓度为(1.068±0.001) g/ml。体积必须尽可能精确地分配;与推荐渗透压和/或密度的任何偏差将影响分离。由于OptiPrep™的粘度,必须特别注意配药。
准备LRP
总是使用新鲜抽取的全血(抗凝剂1.5-2.0 mM EDTA)。富含白细胞的血浆可作为白膜部分或通过红细胞的多聚蔗糖沉降来制备。
白膜:将血液以400 g的速度在摆动桶转子中,大约20℃离心10-15分钟。在血浆上清液(LRP)中获取红细胞顶部的白膜。也将收集一些红细胞,但尽量将其保持在最低限度。80%以上的白细胞可通过这种方式恢复。
红细胞聚集:将9体积的血液与1体积的溶液F温柔倒置混合,使聚集的红细胞沉降到底部(室温20-40分钟);然后吸出全部上清液。
单核细胞分离
在15 ml离心管中,小心地将6 ml LRP层过3 ml密度屏障(避免在界面处混合)。另一种方法是使用注射器和金属套管在LRP上垫上密度屏障,然后大约600 g离心15分钟。20°C的摆动斗转子。允许转子在没有刹车的情况下减速。
离心后单核细胞中包含的上半部分下浑浊的层界面。吸入等离子体上层清液约3毫米以上障碍界面,然后慢慢地吸入的上半部分剩余的等离子体和浑浊的层。这是最好通过使用一个注射器连接到一个金属套管(0.8毫米)必须非常缓慢进行,避免影响淋巴细胞浑浊层的下半部分。颗粒将含有淋巴细胞、多形核白细胞和残余红细胞。
用2体积的溶液C稀释细胞收获物以降低溶液的密度;通过400 g离心10 min使细胞成球并在溶液B中或根据需要重新悬浮单核细胞球。
方法注释
1.盐水溶液中的Tricine可被任何合适的有机缓冲液(例如HEPES)取代。
2.对于其他LRP体积,保持LRP与密度势垒之比为2:1。
3.为了保持单核细胞和淋巴细胞的溶解,在离心后尽可能少地扰动密度屏障层是至关重要的。
4.扁平金属套管可以从许多外科器械公司购买。
相关产品推荐
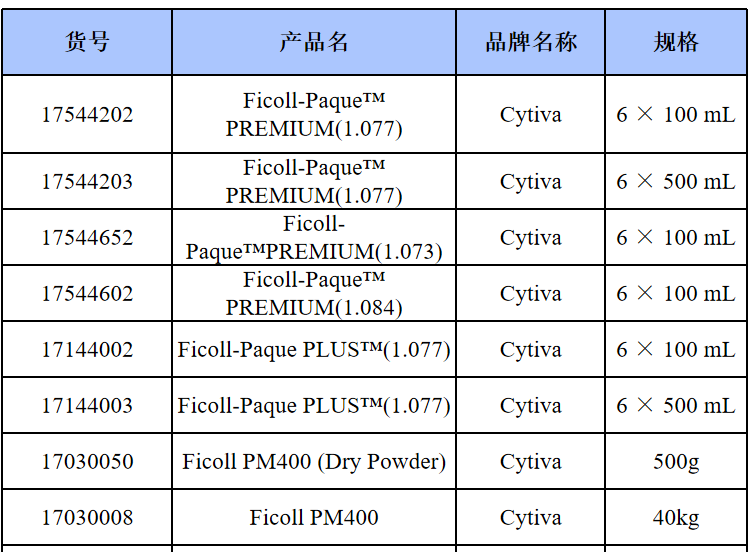
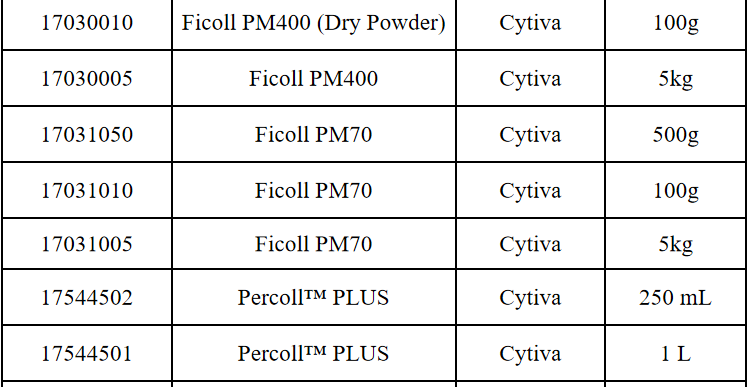

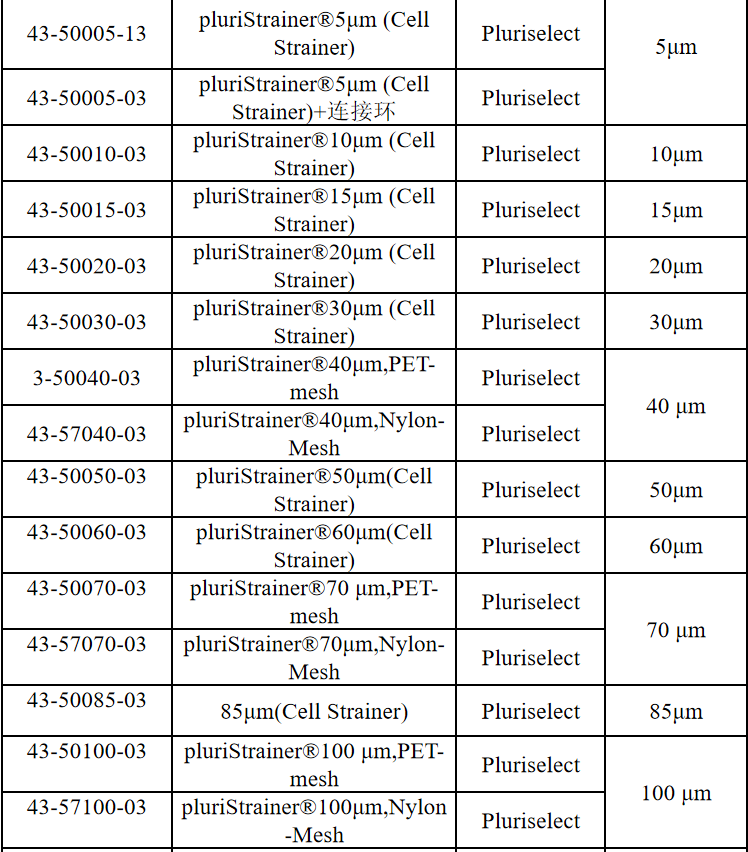
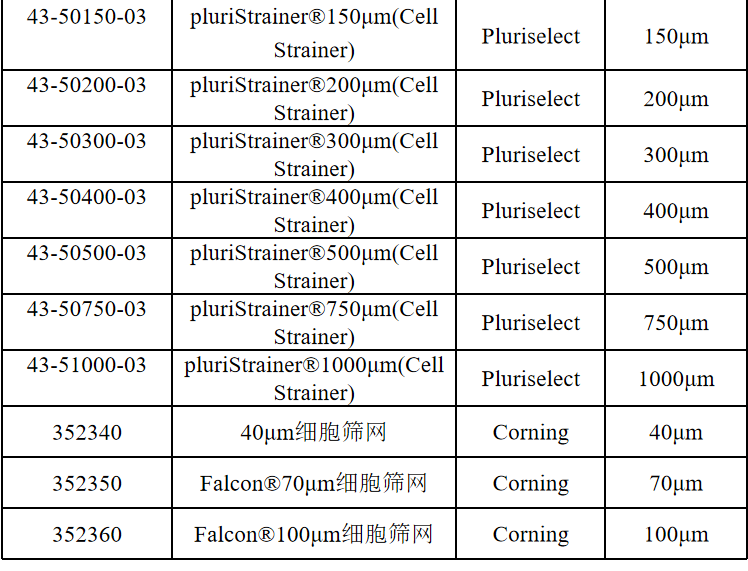
其他细胞品类
别划走,精彩继续

长按识别
添加一对一专属技术支持

扫码进群
咨询详细产品信息

点在看,传递你的品味












