【Serumwerk】从酵母球状体中提取内质网、高尔基体、TGN、核内体和液泡的分离
从酵母球状体中提取内质网、高尔基体、TGN、核内体和液泡的分离不成功、实验做不出来怎么办?新手小白迫切求助,希望各位前辈在文章下方留言,分享自己的经验,为小白们答疑解惑!
溶液制备
A. OptiPrep™
B. 球体裂解缓冲液:0.2 M山梨醇,1 mM EDTA, 20 mM Pipes-KOH, pH 6.8
C. OptiPrep™稀释剂:0.6 M山梨醇,6 mM EDTA, 120 mM Pipes-KOH, pH 6.8
D. 碘克沙醇(50% w/v)工作液:混合5体积OptiPrep™+ 1体积溶液B
E. 间断梯度溶液:40%、30%、25%、20%、15%和10% (w/v)碘克沙醇(稀释溶液D和溶液B)
F. 连续梯度:40% (w/v)碘克沙醇(稀释溶液D加溶液B)
试验方法
在0-4℃下进行所有操作。
1.使用标准程序制备球质体裂解液。
2.通过500 g离心5 min沉淀细胞碎片和细胞核。
3.通过抽吸除去上清液并以100,000 g离心20-30 min以制备总膜部分。
4.将颗粒重新悬浮于1-2 ml溶液B中。
5.在摇摆桶转子的管中,从溶液B和40% (w/v)碘克沙醇形成12 ml线性梯度(使用双腔梯度发生器或梯度Master™)或从0.5 ml 50%,1.5 ml 40%和30%,2.0 ml 25%,3 ml 20%和15%,2 ml 10%碘克沙醇形成不连续梯度。
6.将1 ml 100,000 g颗粒悬浮液置于梯度之上以填充管。
7.离心机在100-180,000 g的情况下运行16小时,允许转子从2000转/分钟开始减速,没有刹车或使用受控的慢减速程序。
8.通过导管穿刺、用致密介质向上移位或从半月板抽吸收集梯度0.5 ~ 1.0 ml。
方法注释
裂解介质和梯度溶液
Shintani所用的裂解缓冲液除在溶液B中列出的试剂外,还含有50 mM的乙酸钠。另一方面,Kim等所使用的另外含有1 mM DTT和1 mM MgCl₂。还应根据需要添加蛋白酶抑制剂。
梯度溶液的制备通过稀释50% (w/v)碘克沙醇工作溶液(溶液D)进行,该溶液含有相同浓度的EDTA (1 mM)和缓冲液(20 mM管道)作为裂解缓冲液和0.1 M山梨醇。山梨醇的浓度低于溶解缓冲液,因为碘克沙醇也对溶液的渗透压有影响。为了解释裂解缓冲液中额外的成分,溶液C也可能含有其正常浓度的6倍(例如300 mM醋酸钠或6 mM DTT + 6 mM MgCl₂)。以这种方式,EDTA、缓冲液和乙酸盐或DTT + MgCl₂的浓度在梯度中保持恒定。然而,如果认为这一点不重要(甚至不需要),则可以简单地通过使用裂解缓冲液稀释OptiPrep™来制备梯度溶液。应根据需要将蛋白酶抑制剂添加到溶液B和C中。
转子要求
该方法可以根据需要放大或缩小,以使用大或小体积转子。它可能适用于一个垂直或接近垂直的转子,在这种情况下,离心时间可以大大减少。
球体裂解
为了破坏球质体,通过过滤器挤压球质体(3 μm孔径)悬浮液;其他工人使用标准的液体剪切均质装置,如波氏或紧合的Dounce均质器或差分裂解。无论使用何种方法,其目的都必须是尽可能温和地破坏球质体,以避免破坏脆弱的细胞器,但同时也要达到至少90%的破坏。
差速离心(分离)
将500 g上清液以10000g离心10 min,如果需要,可以将大部分较大的细胞器成球。或者,如果裂解液的体积较小,则可以省略100,000 g的步长,并将整个500 g的上清液应用于梯度上。然而,在过夜离心过程中,这部分的胞质蛋白会扩散和沉积到梯度中。
梯度施工和样品分层
将样品分层在梯度顶部的另一种方法是将样品分层在密集介质中,梯度下面是通常用于哺乳动物细胞膜分离的策略,通常会产生更好的分辨率。
梯度分辨率
使用10-50%的梯度(由不连续梯度的扩散形成)来研究一种蛋白质(Apg2p)的分布,这对自噬小体的形成至关重要。Apg2p并没有精确地与任何其他已识别的标记共定位,尽管它与ER标记重叠,但一些含有Apg2p的更密集的部分缺乏ER标记。
Kim研究了细胞质物质到液泡的转运,确定了细胞质-液泡靶向(Cvt)途径。特别是使用梯度(连续0-40%碘克沙醇)来确定Cvt9的定位,Cvt9是prAPI选择性递送到液泡所需的蛋白质。Cvt9不共定位于空泡、核内体、TGN和ER;事实上,它有自己非常独特的分布模式。
Sakakibara等人通过使梯度跨度的密度范围更小,能够提高一些膜室的分辨率;梯度由16-60% (v/v) Optiprep™构建,约相当于9-36% (w/v)碘克沙醇,在顶部装载500 g上清后,以150,000 g离心16小时。梯度可以提供非常独特的空泡、内体、内质网、顺式高尔基体和线粒体带。有趣的是,野生型酵母的条带与opi3∆变异体不同。
最近Sakakibara等人使用0.2 M山梨醇,5 mM EDTA, 20 mM HEPES-KOH缓冲液(pH 7.2)产生15-60% (v/v)的OptiPrep™梯度(150,000 g 16 h)获得了液泡,核内体,内质网,线粒体和顺式高尔基体的独特轮廓。
浮选分离
Mitsui等人在(0.8%山梨醇,10 mM三乙醇胺,1 mM EDTA, pH 7.4)中悬浮球质体裂解液膜。将悬浮液调整为35% (w/v)碘克沙醇并使用连续的12-30% (w/v)碘克沙醇密度梯度覆盖并将100,000 g离心16 h。一种更容易的替代方法是首先制备梯度,然后用样品覆盖。后期的核内体和空泡成分在梯度的顶部被回收,它们从质膜中很好地分解,质膜在梯度的三分之一处达到峰值。细胞质蛋白保留在原始样本区。
较短的离心时间的方法
有使用酵母膜分析的较短时间和较低g-力两者的几个示例。梯度通常但不是唯一,跨度更小和更低的密度范围。
1.从球质体匀浆中提取的16000 g颗粒在0-25% (w/v)的碘克沙醇梯度上分离,仅14,000g离心2小时。梯度系统能够分离ER、液泡和晚期内体部分,并在细胞壁形成和蛋白质分选的研究中用于定位Bph1p到晚期内体和液泡结构。
2.Welker等人在垂直转子中使用2.25-24% (w/v)的碘克沙醇梯度,48000 g离心1.5小时。液泡、质膜、内质网、核内体、线粒体和过氧化物酶体标记物的独特但重叠的轮廓。一种主要定位于PM和内体的应激蛋白(Hsp12)。
3.类似的梯度表明Yke4p(一种锌转运蛋白)与内质网而不是高尔基相关。
4.Diaz等使用浮选梯度追踪溴病毒复制蛋白1a。将球体溶解于150 mM NaCl, 5 mM EDTA, 30 mM Tris-HCl, pH 7.5中。在500 g澄清5 min后,将裂解产物调整为40% (w/v)碘克沙醇并且0.6 ml覆盖1.4 ml 30% (w/v)碘克沙醇(并用裂解缓冲液填充)。大约离心后。20万gav作用2 h后,ER漂浮至梯度顶部。缺乏1a的CAP或HEL片段的表达大大降低了ER的浮选效率。
5.Toulmay和Prinz对PM-ER接触位点的研究发现(使用或多或少相同的方法)质膜标记物Pma1p的低密度带,并观察到突触外膜样-线粒体-脂质结合蛋白(SMP)结构域将GFP从高密度转移到低密度。
自噬体(Autophagosome)
Yamamoto在一个非常浅的梯度上解析自噬体。将澄清的裂解产物分层到4.5-18% (w/v)碘克沙醇梯度上并且在200,000 g下离心1 hr。高尔基体膜在顶部两部分中呈明显带状;核内体主要分布在组分1-7中,而自噬体主要分布在组分8-10中。最近,这些粒子也在上文第4部分所述的长自旋梯度中被鉴定:将0-30% (w/v)碘克沙醇梯度在100,000 g下离心20 h。
自生成梯度
在对囊泡形成膜的研究中,将10,000 g的颗粒悬浮在1 ml 35% (w/v)的碘克沙醇中,并在等体积的30% (w/v)碘克沙醇下分层,顶部有1 ml裂解缓冲液,在用于Beckman TLA 100.3转子的管中。将样品在约浓度离心。15万克18小时。形成的梯度部分是通过扩散,部分是通过自生。
相关产品推荐
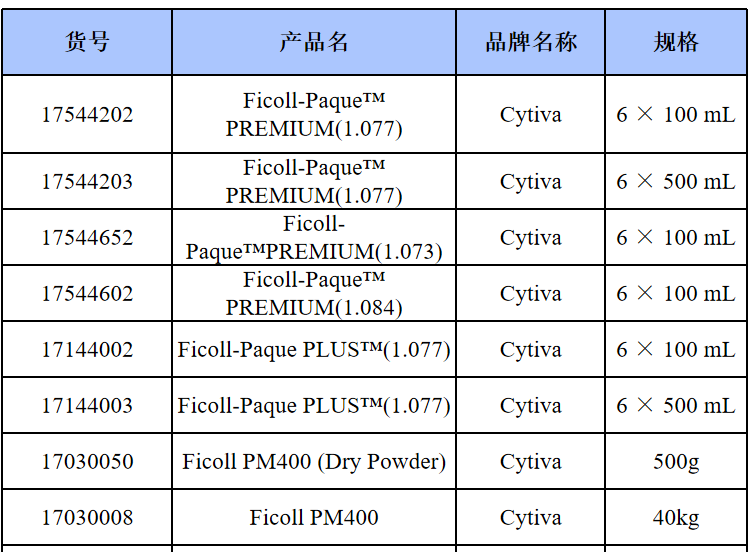
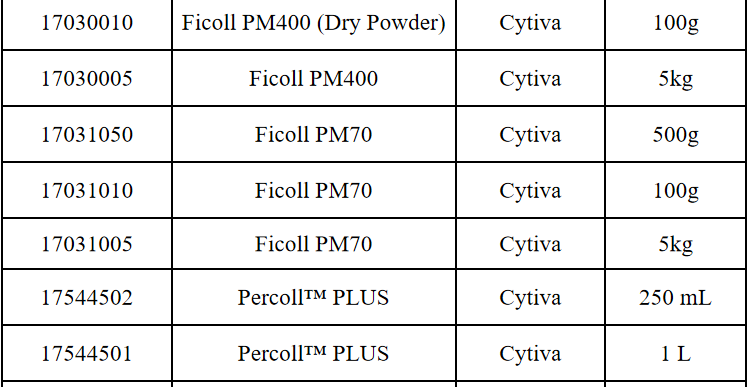

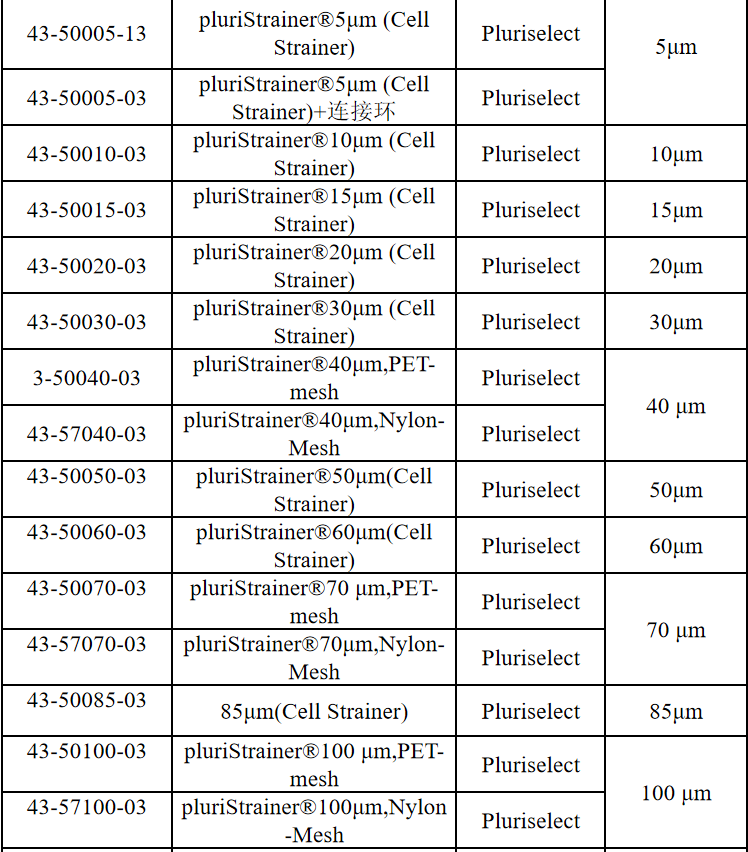
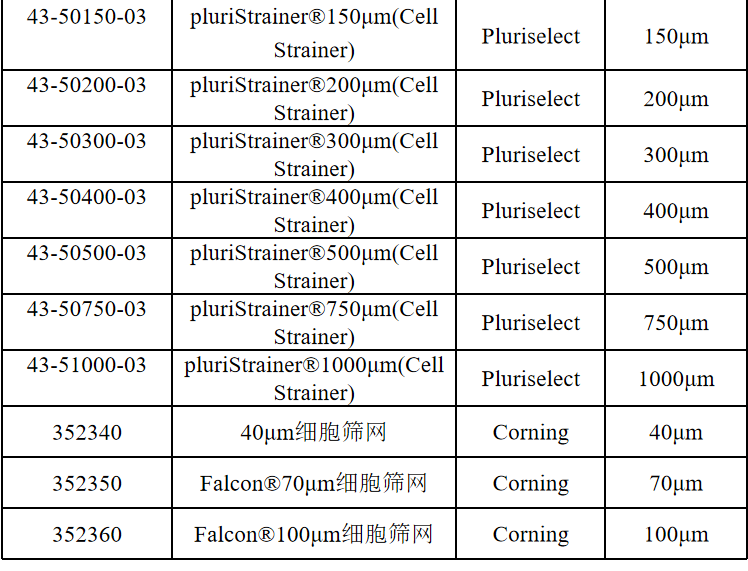
其他细胞品类
别划走,精彩继续

长按识别
添加一对一专属技术支持

扫码进群
咨询详细产品信息

点在看,传递你的品味












