【Serumwerk】全血分离富含单核细胞部分(a monocyte-rich fraction)——浮选法
全血分离富含单核细胞部分不成功、实验做不出来怎么办?新手小白迫切求助,希望各位前辈在文章下方留言,分享自己的经验,为小白们答疑解惑!
溶液制备
A. OptiPrep™
B. 8.5% (w/v) 氯化钠
C. 稀释剂:含10%血清的常规培养基(如RPMI或DMEM)。
试验方法
所有操作均使用聚丙烯管。在去除等分物之前,请注意轻轻混合OptiPrep™。
1.采用EDTA (2 mM终浓度为抗凝剂)采集10 ml血液。
2.配制1.070 g/ml或1.072 g/ml或1.074 g/ml的密度屏障溶液,将溶液a与溶液C按下列体积比之一混合:分别为11.8 + 48.2,12.2 + 47.8或12.6 + 47.4。
3.将5.4体积的A溶液与0.6体积的B溶液混合,得到54% (w/v)的碘二醇溶液。
4.将2ml 54%碘沙醇与10ml全血混合,进行几次非常温和的倒位。
5.在15ml离心管中,将6ml选定的密度屏障溶液在4ml血液上分层,然后在上面分层约0.5 ml溶液C。
6.在摆动桶转子中离心700 g,在20℃下离心30分钟。减速时不要使用刹车。
7.收集浮在1.072或1.074 g/ml层顶部的单核细胞。条带可能相当分散,占据2-3 ml。
8.用2体积Solution C稀释收集的细胞,离心收获,并根据需要在任何介质中轻轻重悬颗粒。
方法注释
1.目前尚未确定,如果溶液C的离子强度与OptiPrep一致增加,是否可以提高收率或纯度(见方案第3步)。
2.低密度屏障的密度选择在一定程度上取决于操作人员的要求。使用1.072 g/ml的屏障将使单核细胞制剂纯度约为85-90%(根据酯酶染色估计),但收率仅为约30%。1.074 g/ml的密度屏障可以回收更多的单核细胞(约占总数的60%),但淋巴细胞的污染比例更大(约为80-85%)。1.070 g/ml的屏障尚未被研究。
3.对于大鼠血液,建议上层浓度为1.076 g/ml。
4.该方案描述了使用含有10%胎牛血清的常规培养基稀释OptiPrep制备的单一低密度层,但约1.084 g/ml和1.068 g/ml的双层格式可能会提供更好的单核细胞纯度。
5.该方法仅适用于健康人的新鲜血液(抽取后2小时内使用),并且EDTA作为抗凝剂。
6.分离过程不需要最上层的培养基,但它避免了细胞在液/气界面处的带状,也防止了细胞在弯月面处粘附在管壁上。
7.这种方法有许多可能的变体,可以加以研究。例如:(1)使用50ml离心管,使样品占用的径向距离更小,这可能伴随着增加低密度屏障的体积,或(2)使用两层梯度格式。
8.将离心时间延长至40 min可提高单核细胞的产量,且密度屏障较低。
9.单核细胞的纯度较低。然而,这可能被认为在更经济地使用抗体包被的淋巴细胞过程中是一个非常有用的初步步骤。
相关产品推荐
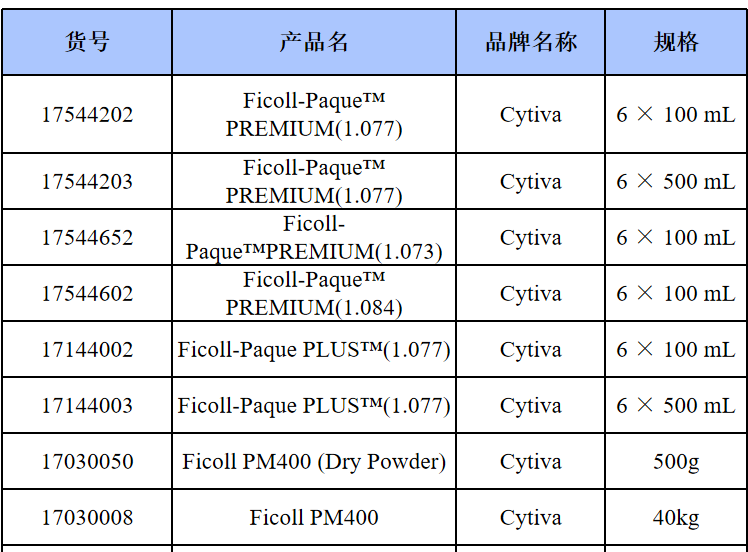
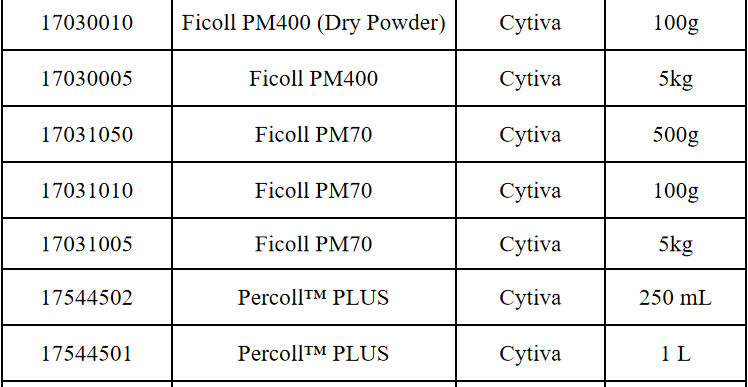
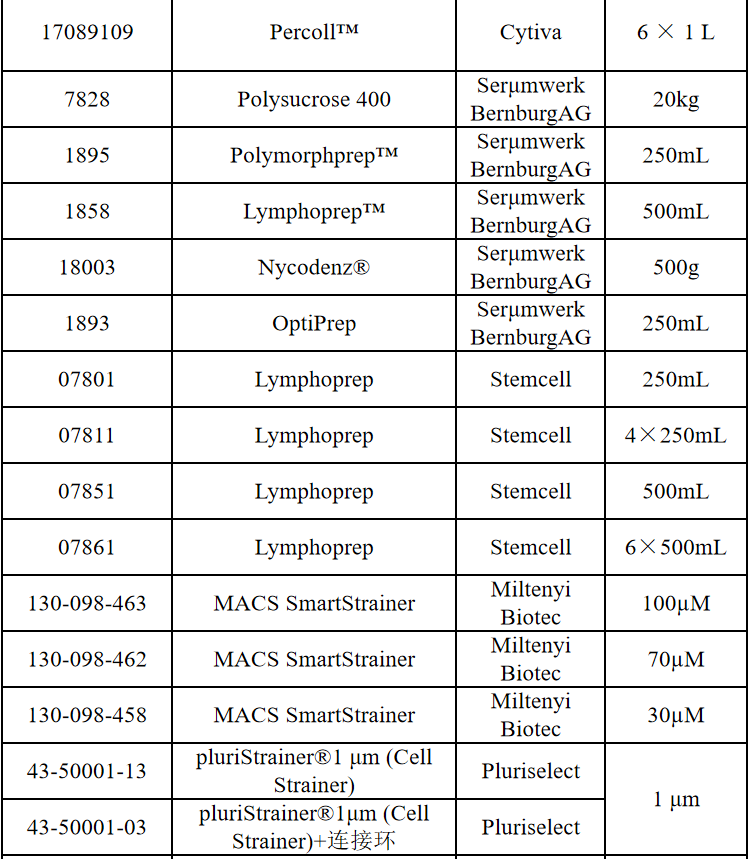
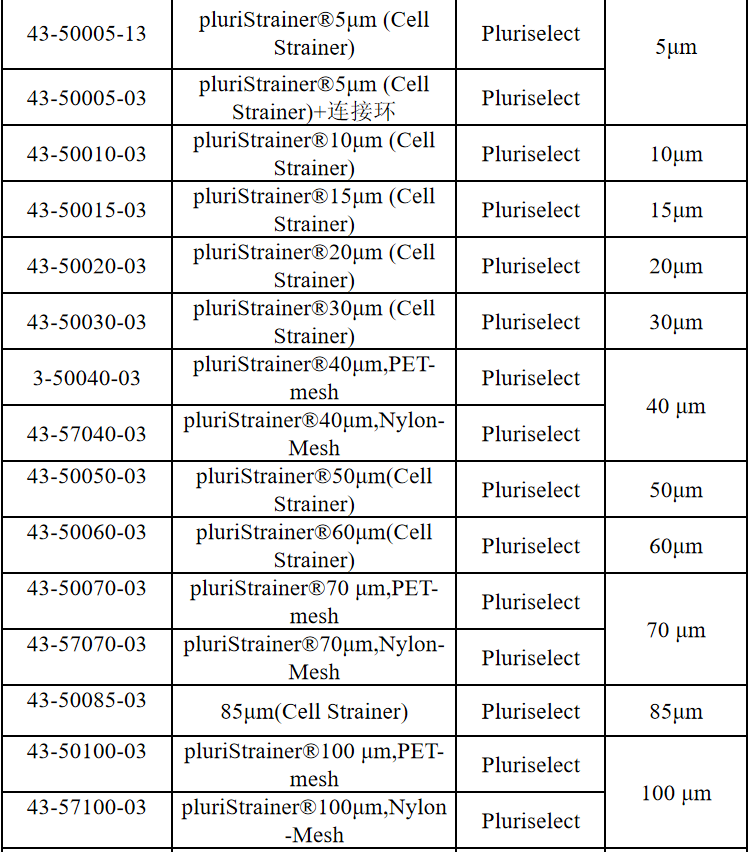
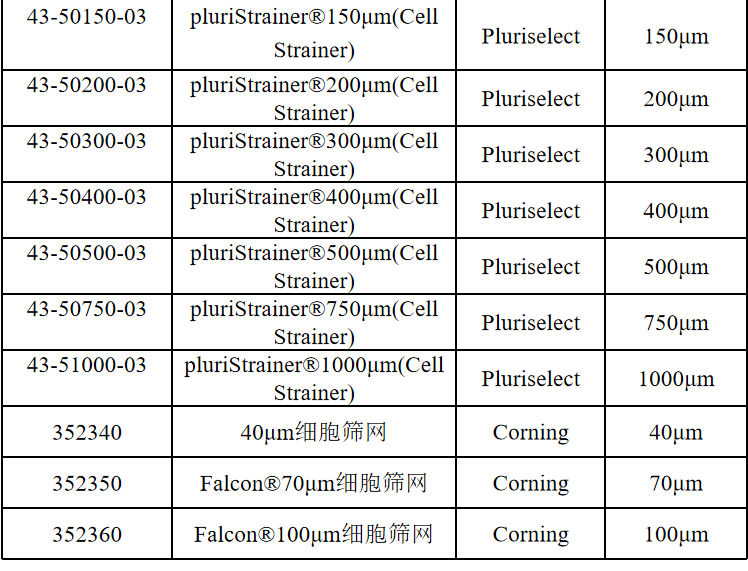
其他细胞品类
别划走,精彩继续

长按识别
添加一对一专属技术支持

扫码进群
咨询详细产品信息

点在看,传递你的品味












