【Serumwerk】慢病毒—人类免疫缺陷病毒-1(HIV-1)和慢病毒载体纯化
慢病毒纯化不成功、实验做不出来怎么办?新手小白迫切求助,希望各位前辈在文章下方留言,分享自己的经验,为小白们答疑解惑!
病毒浓度进入致密缓冲
溶液制备
A. OptiPrep™
B. 生理盐水缓冲溶液(Hepes或磷酸盐缓冲液)
试验方法
1.收集细胞上清并通过0.45μm滤器过滤。
2.将约32-33 ml上清液转移到用于摇摆桶转子的管道中,并在底层注入5 ml OptiPrep™。使用锥形管,上清液的体积可为28-29 ml,含1-2 ml OptiPrep™。
3.在4℃下以50,000 g离心1.5 h。
4.仔细抽吸除2-3 ml外的所有上清液;在锥形管中,这可以减少到1-2 ml。
5.在残留的上清液中收集带状病毒,尽可能少地去除缓冲液。
6.如果病毒悬液的密度过高而无法加载到后续梯度上,则用1体积的B溶液稀释其并在4℃ 6000 g下将病毒颗粒化24 h。
沉降速度梯度中的HIV-1净化
溶液制备
A. OptiPrep™
B. 磷酸盐缓冲盐水
C. 梯度溶液:用溶液B稀释OptiPrep™,以1.2%的步骤给出一系列密度从6到18% (w/v)碘克沙醇的溶液
试验方法
1.从约制备一个不连续梯度。每种密度溶液各1 ml。
2.首先使用蠕动泵将每1毫升液体吸到塑料管中,然后将液体反向流动,在较密的一层上轻轻排出。
3.将浓缩病毒悬液(约1.0 ml)置于梯度上方并以200,000 gav离心1.5 h。
4.首先以低密度端向上位移收集梯度,约0.8-1.0 ml。病毒明显地出现在梯度的底部1 / 3处。
HIV-1纯化
试验方法
1.将等体积的澄清细胞上清液和OptiPrep™混合,然后在选定的垂直或接近垂直的转子中离心。使用约350,000 gav 3-3.5小时。
2.使用慢减速程序或关闭刹车低于2000转。
3.先用导管穿刺收集梯度密集端,如果导管类型允许,先收集低密度端,用密集介质向上移位或从半月板抽吸。
HIV-1的纯化在一个预先形成的连续梯度中
溶液制备
A. OptiPrep™
B. 原液100x缓冲液:2 M NaCl, 100 mM MgCl2, 50 mM β-巯基乙醇,500 mM Tris-HCl, pH 7.4
C. 缓冲液:20 mM NaCl, 1 mM MgCl2, 0.5 mM β-巯基乙醇,5 mM Tris-HCl, pH 7.4
试验方法
1. 从11 ml OptiPrep™、1.0 ml水和120 μl溶液B中制备约55% (w/v)的碘克沙醇溶液,用溶液C进一步稀释,制成50%、45%、40%、35%、30%、25%和20% (w/v)碘克沙醇溶液。
2. 在4 ml管中为摇摆桶转子层各0.45 ml的8种碘克沙醇溶液,先密端并让梯度在室温下扩散4 h。
3. 将梯度调到4℃,并在梯度的顶部放置约0.4 ml的病毒溶液,以填充试管。
4. 15万g离心20小时,使用缓慢加速和减速(到和从约3000转/分)程序,如果可用;如果不能在3000转/分钟的减速过程中转动刹车。
5. 首先在约0.4 ml分数低密度端卸载梯度。HIV-1条带位于梯度的上1 / 4。
方法注释
1.把病毒集中到缓冲层上的最好的旋翼是摇摆桶式的旋翼,最好的管是贝克曼公司的锥形底的“锥状”管。靠近其底部的管的小横截面积意味着可以使用更小的体积的缓冲,并恢复带状病毒,而不同时吸入缓冲本身,是容易的。
2.在含有病毒的液体的衬垫下,使用连接在长金属套管上的注射器当然是首选的方法。如此小体积的缓冲液与大体积的上清液叠加必然会导致混合问题。
3.Coleman等使用2.5 h。
4.允许转子减速使用慢减速程序或关闭制动低于2000转,以避免“科里奥罗斯”混合带状病毒。
5.使用注射器+长金属套管先取下坐垫可能更方便。
6.Coleman等人仅使用0.22 ml缓冲液,除去所有上清液(除最后0.22 ml外),收集所有剩余液体(包括缓冲液),用缓冲液稀释悬浮液2.5倍后进行24 h离心。如果使用更大体积的缓冲液,则试验方案中步骤4和步骤5所述的方法应该可以在不移除超过0.2 ml缓冲液的情况下,从锥形管中轻松收获条带病毒。
7.目前尚不清楚这些方法中任何一种对逆转录病毒科其他成员的纯化有多广泛的应用,但很可能每一种方法都可用于其他类型的病毒,即使可能需要优化梯度的密度范围和/或离心条件以使纯度最大化。
8.有时0-18%碘克沙醇梯度已被用于纯化HIV-1。
9.可以考虑的一种实际的替代方法是使用连续梯度。如果使用此选项,则仅制备6和18%碘克沙醇。
10.如果要纯化较大体积的粗病毒,则必须使用较大体积梯度。由于这是速率分区分离,因此粗制病毒悬液的体积不应超过梯度体积的约10- 15%。
11.使用更正常的移液管或注射器,需要大量的实践,才能形成许多小体积步骤的不连续梯度,无论使用的是叠层还是底层技术。然而,在离心过程中碘克沙醇会发生扩散,因此从6和18%碘克沙醇制作连续梯度可能更容易。
12.如果需要在按梯度分层之前浓缩病毒,则确保病毒悬浮液的密度足够低以允许按梯度分层。一般使用100,000 g或250,000 g RCFs,偶尔183,000 g或200,000 g。离心时间一般为1.5 h,有时为3.0 h。
13.一个垂直或接近垂直的转子实际上会进一步提高分辨率,因为在离心过程中,液体在管中的表面积很大,而短的路径长度将意味着更短的离心时间。
14.通过导管穿刺收集梯度可能是一种有用的替代方法。
15.这首先是在一个39毫升管垂直转子(Beckman VTi50)中进行,在24万g的6小时,之后在5毫升管接近垂直的NVT100中进行,在42万g的3.5小时。
16.该方法是一种高分辨率的方法- V3环突变体的密度与野生型相比有小的偏移已被报道,并在梯度的密集区域释放Gag条带。
17.由于病毒条带的密度相对较低,可以允许55%溶液的遗漏。50%碘克沙醇溶液可由10 ml OptiPrep™、2.0 ml水和120 μl溶液B配制而成。也有可能减少步骤数(10%碘克沙醇增量);在4ml的试管中,通过扩散形成连续梯度大约需要6小时。体积越大,扩散时间越长。连续梯度也可以使用双腔梯度发生器或梯度大师™由密度最大和最轻的溶液等体积制成。
18.在较大的重力作用下,较短的时间可能是允许的,但尚未得到验证。
相关产品推荐
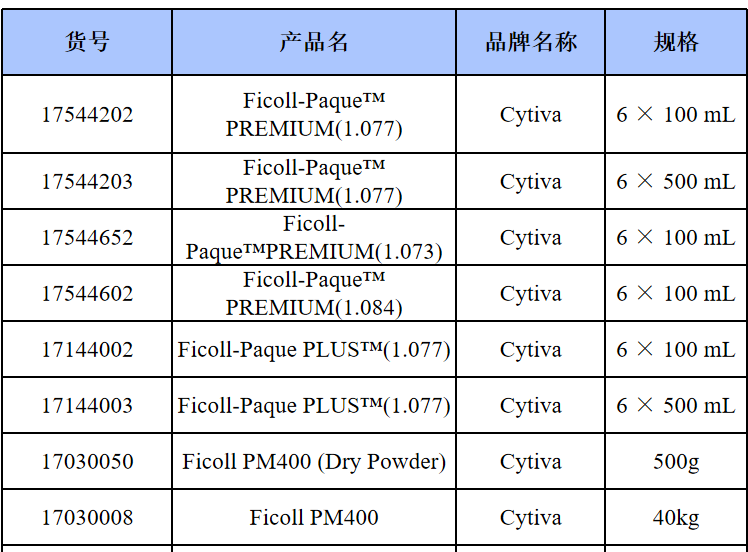
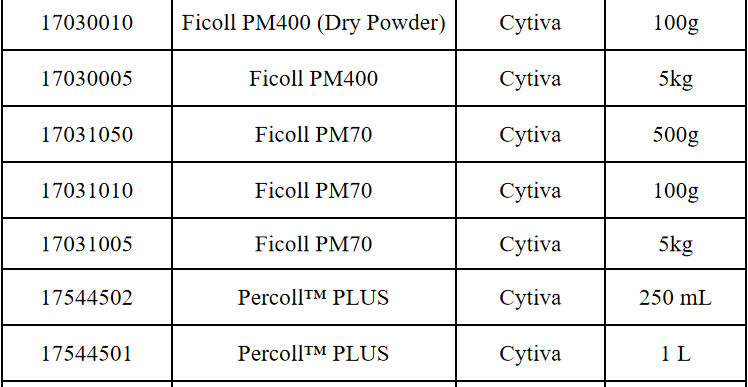
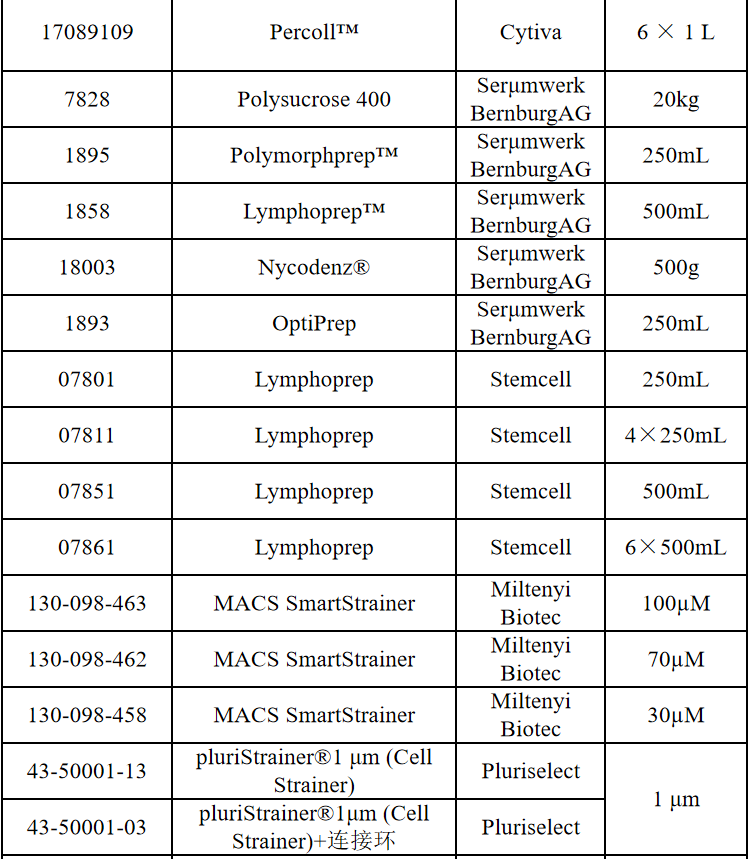
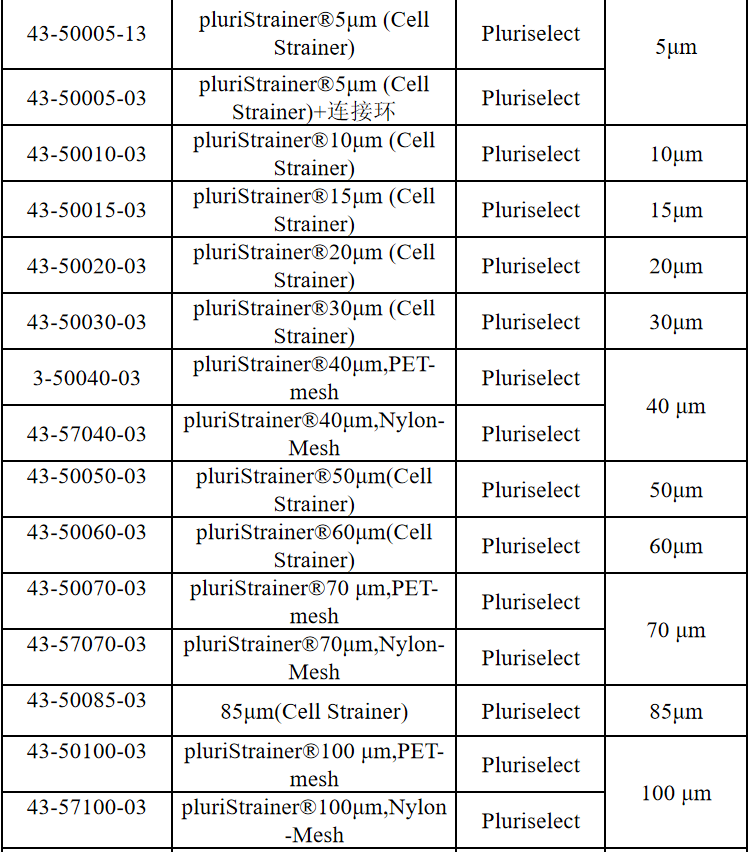
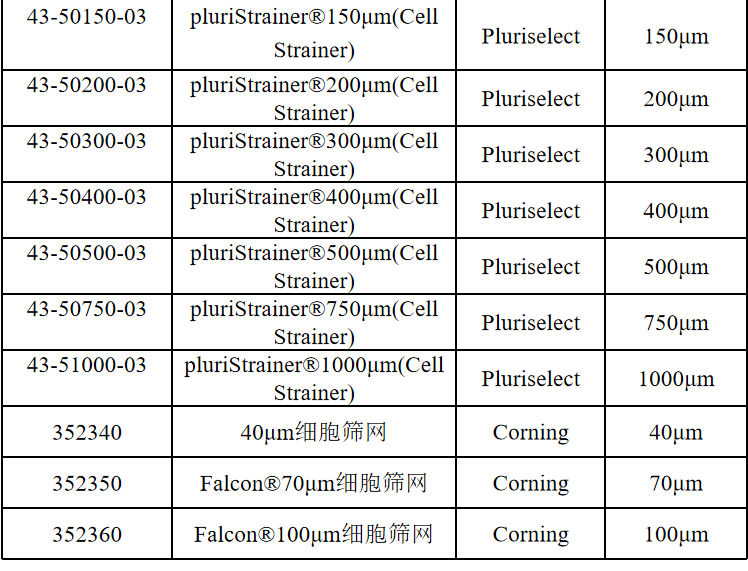
其他细胞品类
别划走,精彩继续

长按识别
添加一对一专属技术支持

扫码进群
咨询详细产品信息

点在看,传递你的品味












