【Serumwerk】双逆转录病毒—梅森-菲舍猴病毒(Mason-fisher-monkey virus)纯化
双逆转录病毒—梅森-菲舍猴病毒纯化不成功、实验做不出来怎么办?新手小白迫切求助,希望各位前辈在文章下方留言,分享自己的经验,为小白们答疑解惑!
沉降速度法
溶液制备
A. OptiPrep™
B. Phosphate-buffered盐水
C. 梯度溶液:用溶液B稀释OptiPrep™,以1.2%的步骤给出一系列密度为6 - 18% (w/v)的碘克沙醇溶液
试验方法
病毒浓度
1.收集细胞上清并通过0.45 μm滤器过滤。
2.通过将病毒颗粒通过密度屏障浓缩病毒。
3.用小体积的B溶液重新悬浮。
梯度净化
1.用每种密度溶液约1ml制备一个不连续梯度。最好的方法是使用蠕动泵将每1毫升液体吸到塑料管中,然后将液体倒转,在较密的一层上轻轻排出。或者,使用双腔梯度发生器或Gradient Master™从等体积的6%和18%碘克沙醇溶液中制备连续梯度(约12 ml)。
2.将病毒悬液(约1.0 ml)分层置于梯度上方,并在4℃下以164,000 gav离心30 min。
方法注释
1.可行的替代方案之一是使用6-18%的碘克沙醇连续梯度,而不是多步骤的不连续梯度。
2.使用转子便于病毒悬浮体积。管的体积以及含病毒的溶液和缓冲液的相对量并不重要,可以随材料的量而变化。
3.Gottwein等人将病毒通过20%蔗糖缓冲层(在53,000g下1 h)制成颗粒;为了维持病毒的等渗环境,可以用15% (w/v)碘克沙醇替代20%的蔗糖。为了避免感染性的丧失,浓缩病毒的理想方法是将病毒沉淀在碘克沙醇的致密垫层上,而不是造粒。然而,由于碘克沙醇在病毒悬液中的浓度需要达到5% (w/v)才能加载到梯度上,这可能对沉降速度分离不太方便。
4.第三种选择是从等体积的6.0%、9.0%、12.0、15.0%和18.0% (w/v)碘克沙醇中形成一个更容易的不连续梯度,并允许通过扩散形成一个连续梯度(约为1.00 w/v)。在室温下放置5小时,或在4°C放置过夜)。
5.如果要纯化体积较大的病毒悬液,则必须使用较大的体积梯度。由于这是一种沉降-速度分离,粗制病毒悬液的体积不应超过梯度体积的10-15%。
6.允许转子在没有刹车的情况下从2000转减速。
7.在另一种10-55% (w/v)碘克沙醇梯度中,在215,000 g离心40分钟,将未组装的蛋白(梯度顶部)与更密集组装的病毒样颗粒分离。
浮力密度法
溶液制备
A. OptiPrep™
B. 磷酸盐缓冲盐水或任何类似培养基
C. 梯度溶液:用溶液B稀释OptiPrep™,得到10%和40% (w/v)碘克沙醇溶液
试验方法
病毒浓度
1.收集细胞上清液;通过0.45 μm的过滤器过滤;然后将病毒从过滤的粗悬液沉淀到OptiPrep™的1 ml(贝克曼SW41Ti)或2.5 ml(贝克曼SW28)垫层上并以35,000 g离心1 h。
2.从垫的正上方回收病毒颗粒,要非常小心,尽可能少地回收。
病毒纯化
1.使用双腔梯度标记器或Gradient Master™从等体积的两种碘克沙醇梯度溶液中为Beckman SW41Ti转子准备约12 ml梯度,或允许等量10%、20%、30%和40% (w/v)碘克沙醇不连续梯度扩散。
2.确保从碘克沙醇垫层收集的病毒悬液具有足够低的密度,以使其在10%碘克沙醇上分层。必要时用B溶液稀释。
3.在梯度上使病毒悬液分层并以35,000 g离心16 h。
4.以一系列等体积分数收集梯度或通过吸入注射器和金属套管获取病毒颗粒。
方法注释
1.使用转子便于病毒悬浮体积。
2.毫无疑问,相对较低的g力,如在该方案中使用,对任何病毒颗粒都是有益的,但通过增加g力到120,000 g,可以将条带时间缩短到3-4小时,尚未清楚对病毒颗粒的传染性有什么影响尚不清楚。
3.野生型病毒颗粒条带为约1.125 g/ml(相当于23% (w/v)碘克沙醇);有趣的是,Gag蛋白加工突变体的条带密度略高。
相关产品推荐
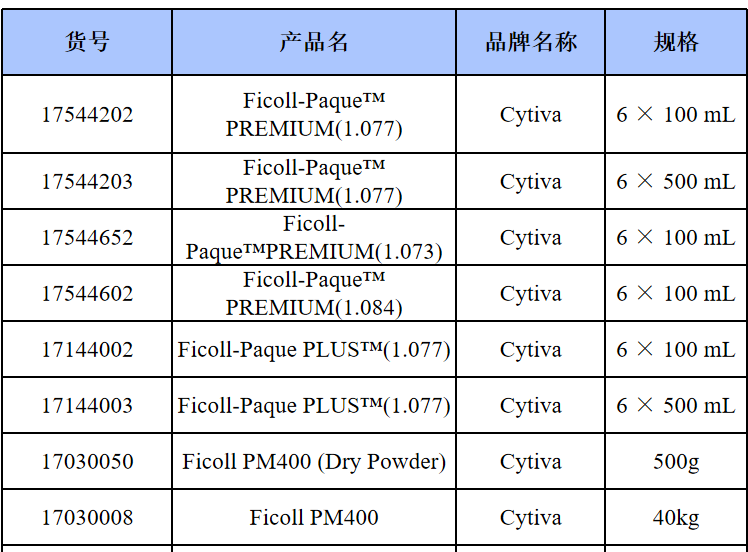
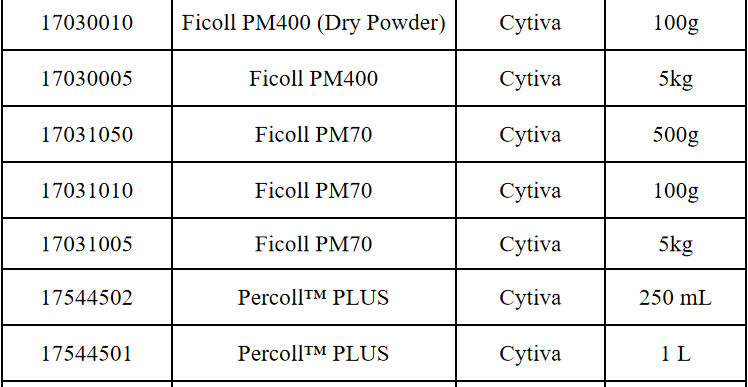
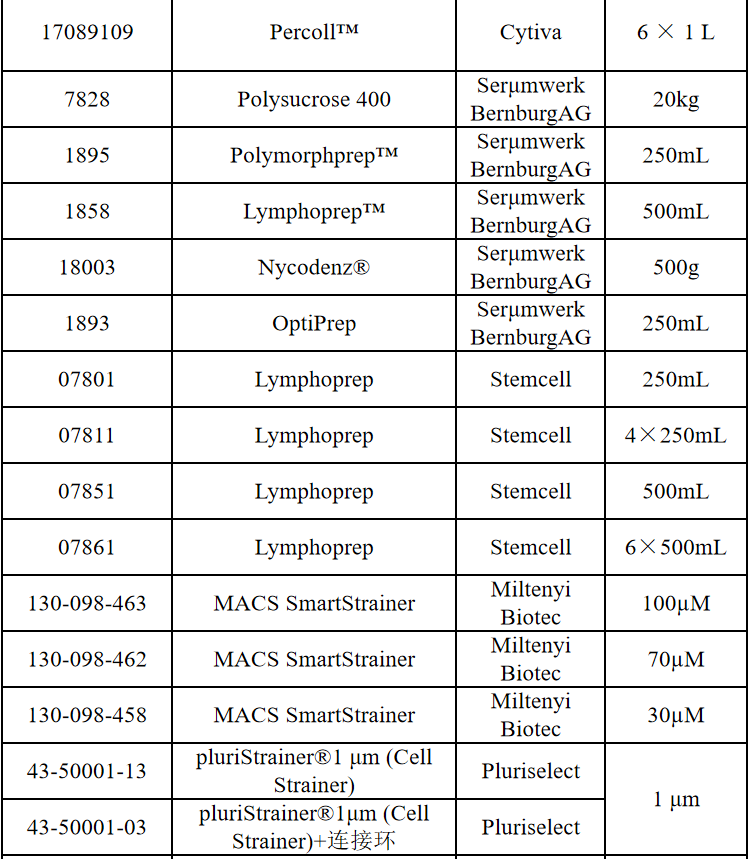
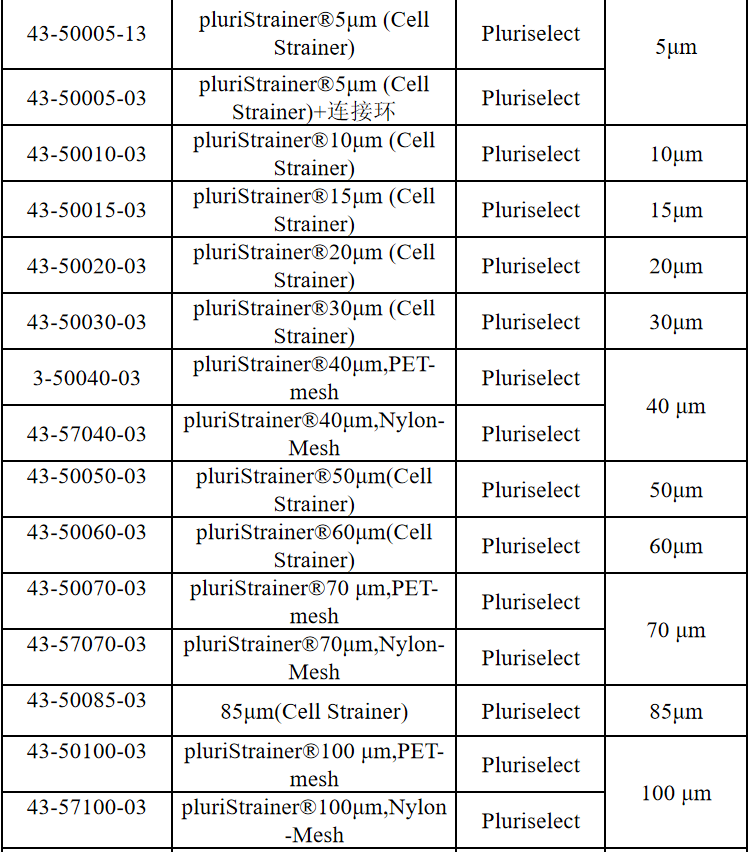
其他细胞品类
别划走,精彩继续

长按识别
添加一对一专属技术支持

扫码进群
咨询详细产品信息

点在看,传递你的品味












