【Serumwerk】细小病毒科——重组腺相关病毒 Recombinant adeno-associated viruses纯化
重组腺相关病毒纯化不成功、实验做不出来怎么办?新手小白迫切求助,希望各位前辈在文章下方留言,分享自己的经验,为小白们答疑解惑!
不连续梯度
溶液制备
A. OptiPrep™
B. 10x磷酸盐缓冲盐水,含10 mM MgCl2和25 mM KCl (10xPBS-MK)
C. 含1 mM MgCl2和2.5 mM KCl的磷酸盐缓冲盐水(PBS-MK)
D. 2 M氯化钠溶液
E. 工作溶液:54% (w/v)碘克沙醇在PBS-MK:混合9体积OptiPrep与1体积溶液B。
试验方法
1.准备以下梯度溶液:15% (w/v)碘克沙醇含1 M NaCl的PBS-MK溶液:1.5体积溶液E + 2.7体积溶液D + 1.2体积溶液C。
2.25% (w/v)碘克沙醇PBS-MK:2.5体积的溶液E + 2.9体积的溶液C
3.40% (w/v)碘克沙醇PBS-MK:4.0体积的溶液E + 1.4体积的溶液C。
4.通过4,000 g离心20 min澄清的细胞裂解物。
5.下层10-15 ml澄清的裂解液,加入9 ml 15%碘克沙醇;6 ml 25%碘克沙醇,5 ml 40%碘克沙醇和5 ml 54%碘克沙醇工作溶液。使用一个长金属套管(0.8 mm i.d)连接到注射器或通过管子连接到蠕动泵来加载管子。
6.在35万g下在18℃下离心1小时。如果该设备是低速加速和减速程序(最高和低于2000转/分)
7.可用在离心机上,或在低于2000转/分钟减速时关闭制动器。
可以先将整个梯度以1- 2ml分割的致密端收集,或者使用注射器插入40%/54%界面下方,抽吸不超过2- 3ml的40%层。
连续梯度
溶液制备
A. OptiPrep™
B. 磷酸盐缓冲溶液
方法注释
1.通过硫酸铵沉淀或色谱法浓缩后,将rAAV悬浮于pH 7.4的磷酸盐缓冲盐水中。
2.将2.7 ml含有rAAV的液体转移到合适的管道和使用OptiPrep™填充管道的底层。
3.密封管后,在Gradient Master中以80°20转/分钟旋转12分钟形成梯度。
4.在16℃以71,000 rpm (348,000 gav)离心3小时。
5.通过试管穿刺从底部收集梯度,接近梯度底部的rAAV条带。
方法注释
1.对于较小的体积管,按比例缩小所有体积。如果转子不能达到350,000 gav,可能需要按比例增加离心时间。
2.可在交替的梯度层中加入酚红(0.01µg/ml),以增强层的视觉识别。350,000 g碘克沙醇本身会沉淀,可能会使界面不那么明显。
3.rAAV与细胞裂解液中蛋白质的聚集可能对其分离造成严重问题,因为聚集物是异质性的,因此表现出广泛的密度。在15%碘克沙醇中加入1 M NaCl可防止这种聚集,并使rAAV在40%碘克沙醇层中以单一条带分离。
4.由于该梯度使用的体积大,使用蠕动泵引入碘克沙醇溶液使这项任务更容易。
5.所有的污染蛋白在25%碘克沙醇层的裂解条带和超过99%的腺病毒污染条带的密度低于rAAV (约1.22 g/ml)。
6.在去除rAAV条带时需要非常小心,不仅要避免任何腺病毒的污染,而且要避免同样以较低密度条带的空衣壳的污染。
7.通过离子交换或肝素亲和层析可直接对含碘克沙醇的部分进行进一步纯化。
8.对于许多应用,如电泳,感染培养的细胞,给实验动物,去除碘克沙醇不是必需的。如果绝对需要去除(或至少降低浓度)碘克沙醇,那么某种形式的超滤被广泛认为是最有效的方法;来自Sartorius的Vivaspin膜和来自Millipore的Centricon Plus 70离心过滤器,或者带有Ultracel PL膜(100 kDa截止)的PBHK centrifuge Plus-20过滤器单元。切向流过滤也是有效的。
9.在ref 2中使用NVT90;其他具有相似沉降路径长度的垂直和近垂直转子可能是合适的。
10.由于rAAV的密度较高,需要保证梯度底部足够密集,以避免rAAV在离心过程中到达管壁。由梯度大师产生的梯度将趋向于向底部急剧增加密度,这将在随后的离心过程中增强。
相关产品推荐
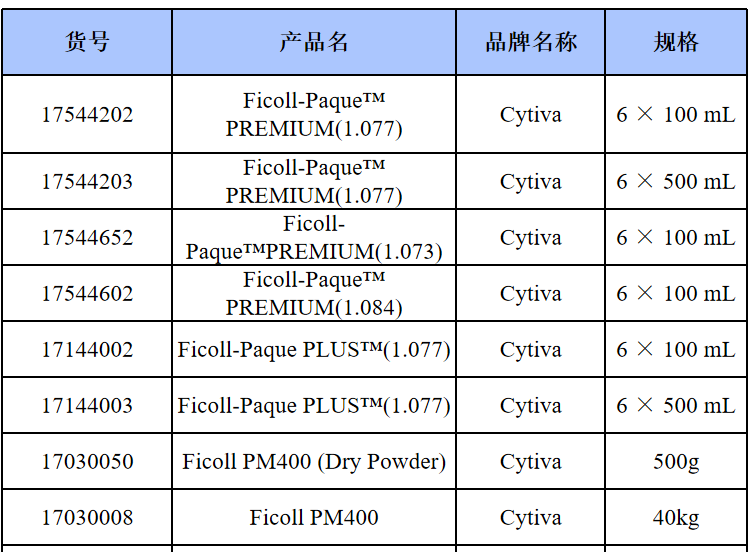
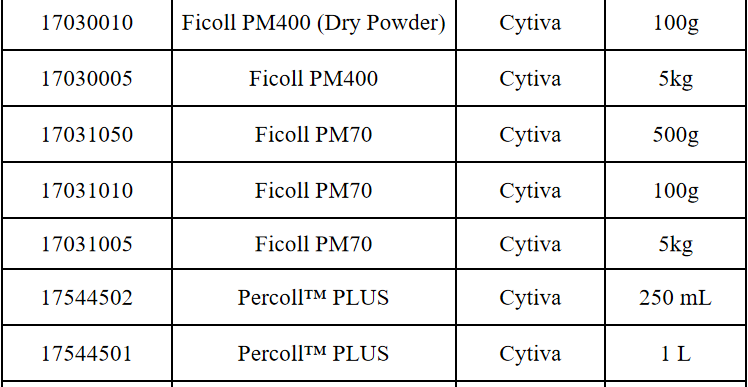
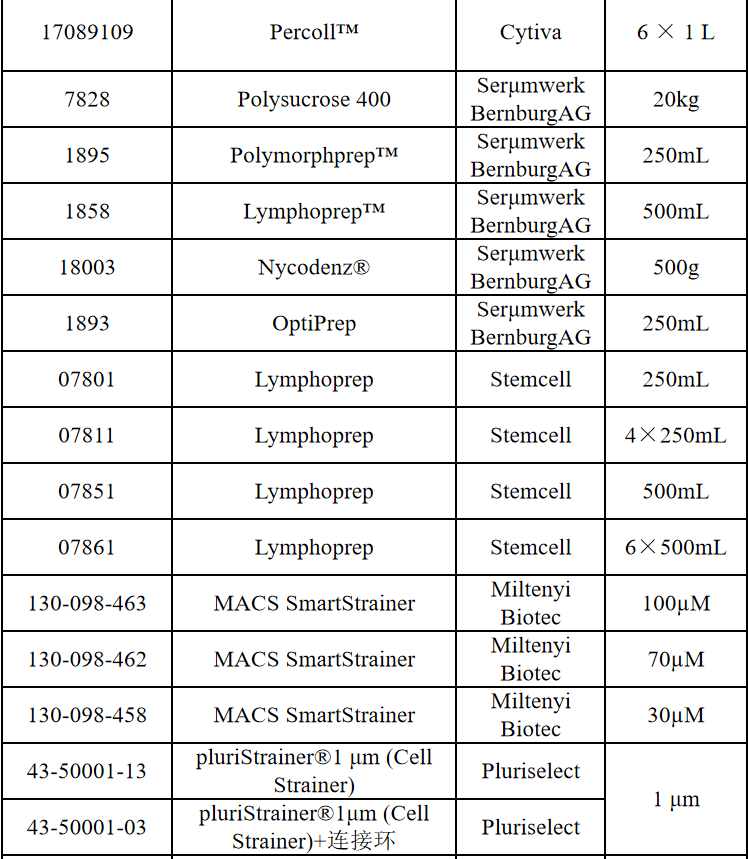
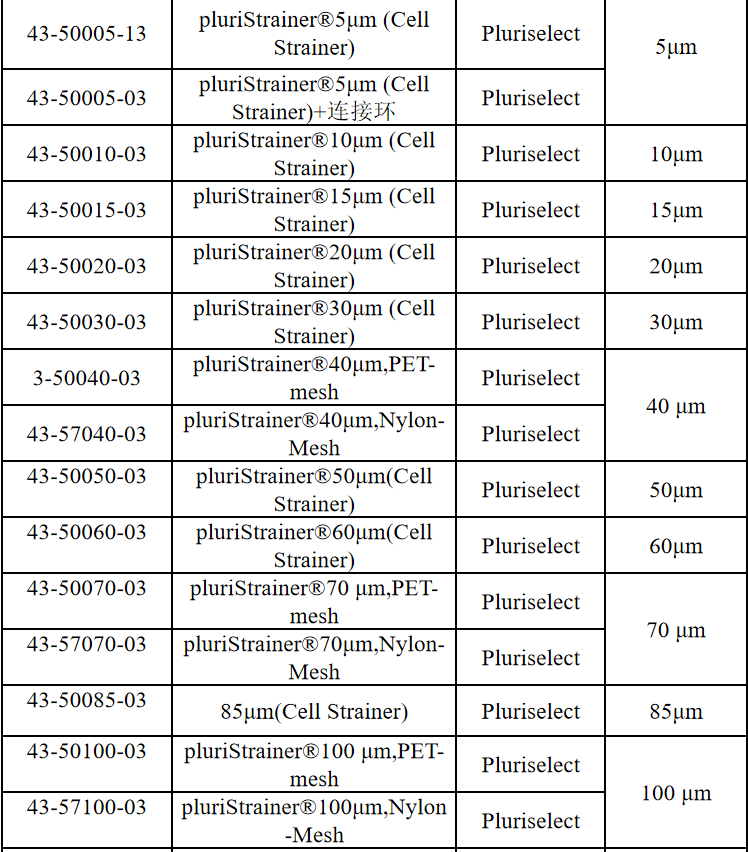
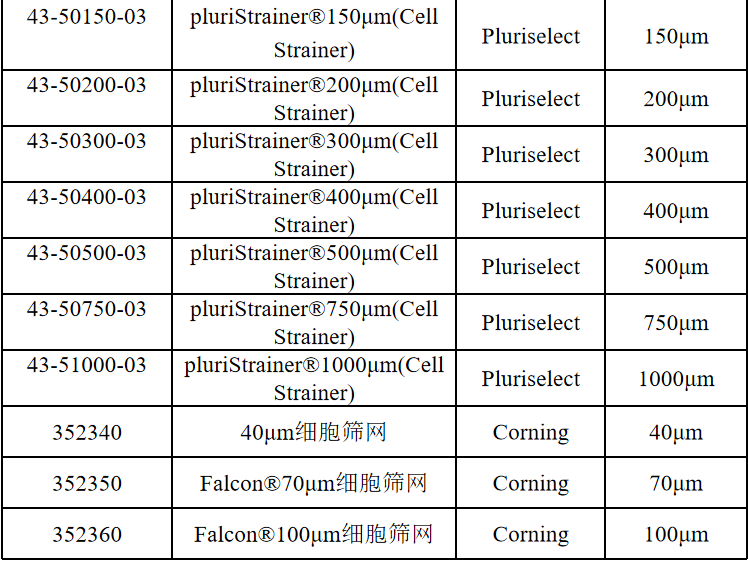
其他细胞品类
别划走,精彩继续

长按识别
添加一对一专属技术支持

扫码进群
咨询详细产品信息

点在看,传递你的品味












