【Serumwerk】多瘤病毒(Polyomaviridae)纯化
多瘤病毒纯化不成功、实验做不出来怎么办?新手小白迫切求助,希望各位前辈在文章下方留言,分享自己的经验,为小白们答疑解惑!
溶液制备
A. OptiPrep™
B. 10xPBS
C. OptiPrep™稀释剂:3.125 M NaCl, 4.5 mM CaCl2, 2.5 mM MgCl2, 10.5 mM KCl
D. 39% (w/v)碘克沙醇工作溶液(WS):混合3.9体积溶液A、0.6体积溶液B、1.2体积溶液C和0.3体积水
E. WS稀释剂:0.6体积的B溶液,1.2体积的C溶液和4.2体积的水混合
试验方法
1.用溶液E稀释溶液D,产生27% (w/v)碘克沙醇溶液,在5 ml摇摆桶转子的管中,使用双室梯度发生器或梯度Master™从等体积的溶液D和27%碘克沙醇溶液制备4.2 ml连续梯度。
2.或配制27%和33% (w/v)的两种碘克沙醇溶液,并通过分层,从这两种溶液和溶液d中的每一种1.4 ml制备不连续梯度。允许梯度在室温下扩散3-4小时。
3.将细胞裂解物置于4℃;通过添加0.17体积的5 M NaCl将盐浓度调整为0.85 M,并孵育10-20分钟。
4.通过在离心机中以5000 g离心10 min来澄清悬浮液。
5.抽吸并保存含有病毒的上清液。
6.将该颗粒重悬于约0.25 ml溶液E中并重复步骤4。
7.抽吸上清液;与第一上清液合并并重复步骤4。
8.将澄清的病毒悬浮液层置于连续碘克沙醇梯度之上并在23.4万g下在16℃离心3.5 h。使用一个缓慢的加速和减速程序从2000转/分上下。如果没有这样的设施,在低于2000转/分的减速期间关闭刹车。
9.通过试管穿刺收集梯度,或者如果条带足够清晰,使用注射器回收条带病毒(大约在管道下方的一半到三分之二处)。
方法注释
1.配制溶液的方式确保了缓冲液和离子的浓度在整个梯度过程中保持恒定。任何适宜的缓冲液均可用于悬浮病毒和制备梯度溶液,其组成因实验室而异。只要缓冲液具有低密度(约1.006 g/ml),梯度之密度将不会受到损害。例如,它可能是细胞培养基(例如DMEM或RPMI),而不是平衡盐溶液。
2.在原始的乳头状瘤病毒法中,以46% (w/v)的碘克沙醇溶液作为原液,从原液中制备出39%、33%和27% (w/v)的梯度溶液。在这种适应中,39% (w/v)的原液被用作最密集的梯度溶液和较低密度溶液的来源。
3.大容积管是允许的(例如贝克曼SW41),但为了补偿较长的沉降路径和较低的RCF,需要增加时间。如果用垂直转子代替摇桶转子(例如贝克曼VTi90或VTi65.1),则较短的沉降路径长度将允许较短的离心时间。
4.对于较大的转子管,按比例扩大所有体积。
5.用于细胞裂解的体积应足够小,以便加载到密度梯度上。Buck等在他们最初的乳头状瘤病毒方法中,每108个细胞使用0.65 ml。虽然密度梯度的作用被认为至少部分是由于沉降速度,但样品的体积可高达梯度体积的2/3。这可能反映出病毒颗粒非常迅速地沉降到梯度界面。
6.将较高和较低的离心速度用于澄清步骤(例如8,000 g和1,500 g ) 15 min。
7.如果病毒悬浮液的体积太大,将其沉淀到一个小的缓冲垫(约0.5毫升)溶液D上;锥形底贝克曼管是理想的。当抽吸带状病毒时,要确保最终的碘二醇浓度不超过15%(w/v),便于对坡度进行分层。Hamloon等将澄清的上清105000g离心90 min,浓缩JC和BK病毒作为颗粒,然后在缓冲液中重悬。Sunyaev等通过40%蔗糖缓冲液100,000 g将JC病毒颗粒化5小时,然后用0.25%脱氧胆酸盐处理。
8.较大体积的转子可以在较低RCFs下使用较长时间,例如SW41在20000g下使用4.75 h。
猴病毒
细胞首先在含有0.5% Brij58的缓冲盐水中溶解,然后在16000 g离心10分钟。将上清液以20%、40%不连续的碘二醇梯度加载,并以约24万g离心2g。病毒在界面处聚集。
相关产品推荐
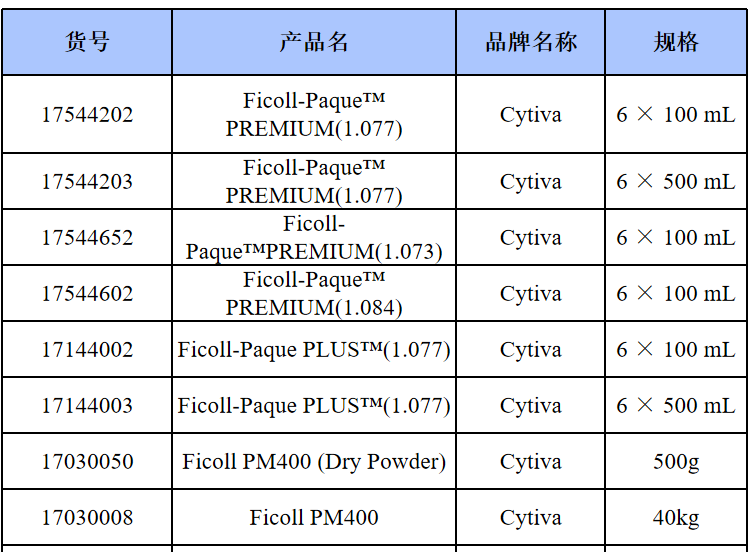
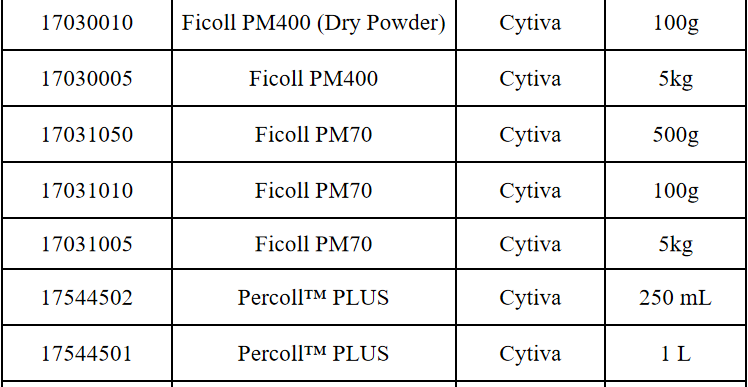
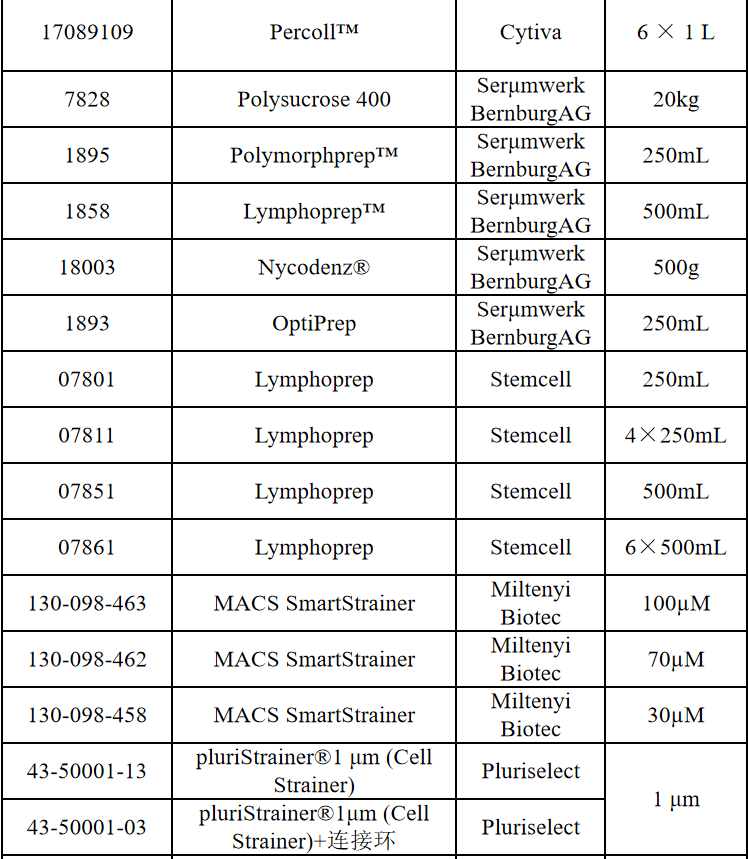
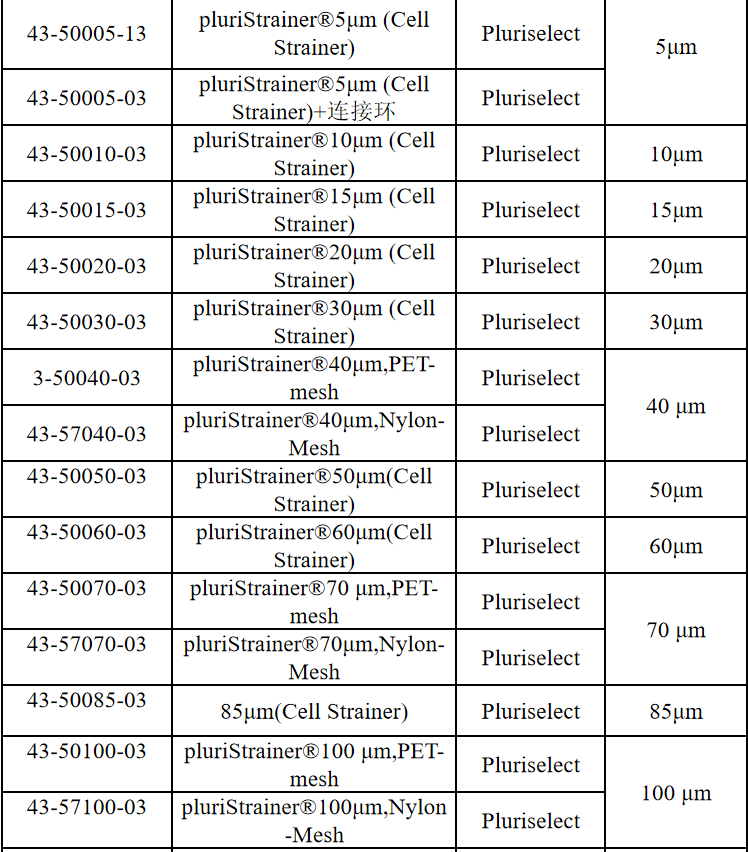
其他细胞品类
别划走,精彩继续

长按识别
添加一对一专属技术支持

扫码进群
咨询详细产品信息

点在看,传递你的品味












