【Serumwerk】海胆体腔细胞群(Coelomocyte cell populations from sea urchins)分离
海胆体腔细胞群分离不成功、实验做不出来怎么办?新手小白迫切求助,希望各位前辈在文章下方留言,分享自己的经验,为小白们答疑解惑!
溶液制备
A. OptiPrep™(使用前轻轻摇瓶)
B. Ca2+/Mg2+-游离海水,含70 mM EDTA,50 mM咪唑,pH 7.5
试验方法
1.用溶液B稀释OptiPrep™,制备以下溶液:3%、6%、12%、18%和42% (w/v)碘克沙醇,并保持在4℃。
2.将一根23号针头(经由造口部)插入海胆体腔内,该针头与装有冷却溶液b的注射器相连。使用与可回收体腔液体体积相等的注射器。
3.把体腔液体抽到注射器里。
4.从五种碘克沙醇溶液各5ml中制备一个不连续梯度。
5.将5 ml含体腔细胞的液体分层置于梯度上方并在4℃下1500 g离心30 min。
使用连接在金属套管上的注射器回收带状材料,如果需要,在造粒和在溶液B中重悬之前,用2-3体积的溶液B稀释。
方法注释
1. Liao等也将描述的方法用于紫癜强丝杆菌。
2. Li使用了类似的密度梯度,将最密集的42% (w/v)碘克沙醇层替换为36% (w/v)碘克沙醇层,用于分离来自绿色海胆圆线虫(Strongylocentrotus droebachiensis)的细胞。
3. 将6%,12%和18% (w/v)碘克沙醇分别加入0.5 M NaCl, 10 mM EDTA溶液中,形成三层梯度分离斑点旁体腔细胞。
4. 四层梯度分离法:OptiPrepTM用0.5M NaCl, 10 mM EDTA稀释,产生10%,20% 30%和70% (v/v) OptiPrep四种溶液(相当于6%,12%,18%和42% w/v碘克沙醇)。以800 g离心30分钟,分离变形虫细胞、振动细胞、无色球形细胞和红细胞。
5. 所述体积适用于标准50 ml离心管。该方法可以按比例放大或缩小-例如,在15 ml的管中使用体腔液和碘克沙醇溶液各2 ml。
6. 如果主要关注的是低密度和高密度的吞噬细胞,则可以研究3%、5%、7.5%、10% (w/v)碘克沙醇的修正梯度。
7. 对于其他类型的棘皮动物,可能需要调节一个或多个层的密度。
8. Arizza等人在7℃下使用800 g 30 min。
9. 为了避免对梯度层的干扰,如果可以的话,使用一个程序化的慢加速,并且为了避免在减速过程中对带状细胞的干扰,关闭制动器。
10. 可见的细胞聚集在一个或多个界面将导致较差的分辨率;这通常是由于使用了过高的细胞浓度。如果使用其他种类的海胆或海葵,这个问题可能会被夸大。如果这个问题仍然存在(尽管降低了细胞浓度),可以通过将样品调整为2.5% (w/v)碘克沙醇来缓解,这样细胞,特别是碎片,沉淀到第一界面的速度会更慢。
11. 要么抽吸可观察到的带状物质,要么从半月板上仔细抽吸出整个梯度;使用扁头金属套管(0.8毫米内径)连接到1-2毫升注射器。大多数梯度卸料机是设计用于柔性薄壁管,而不是常规用于电池的螺旋帽厚壁管。
12. 根据密度的增加,阿米巴细胞占90%,振动细胞占84%,未着色小球体占90%,红细胞(球)占91%。
相关产品推荐
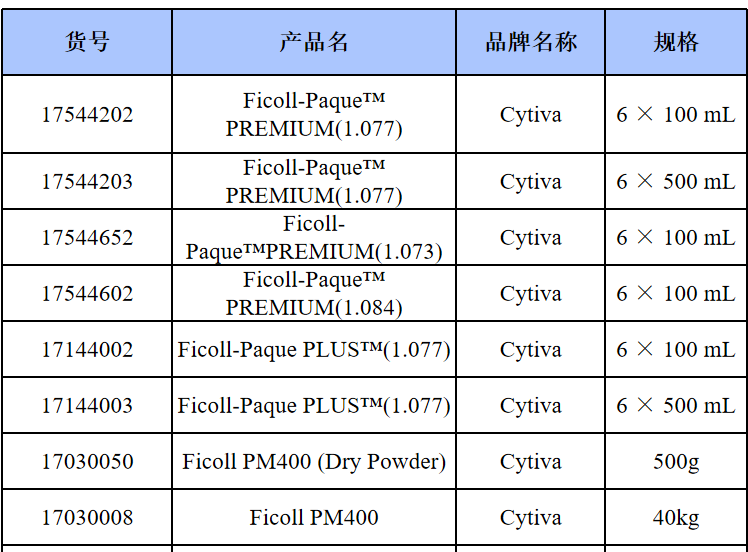
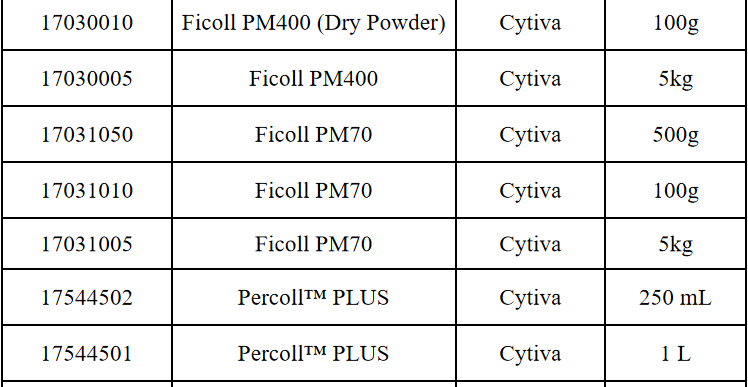
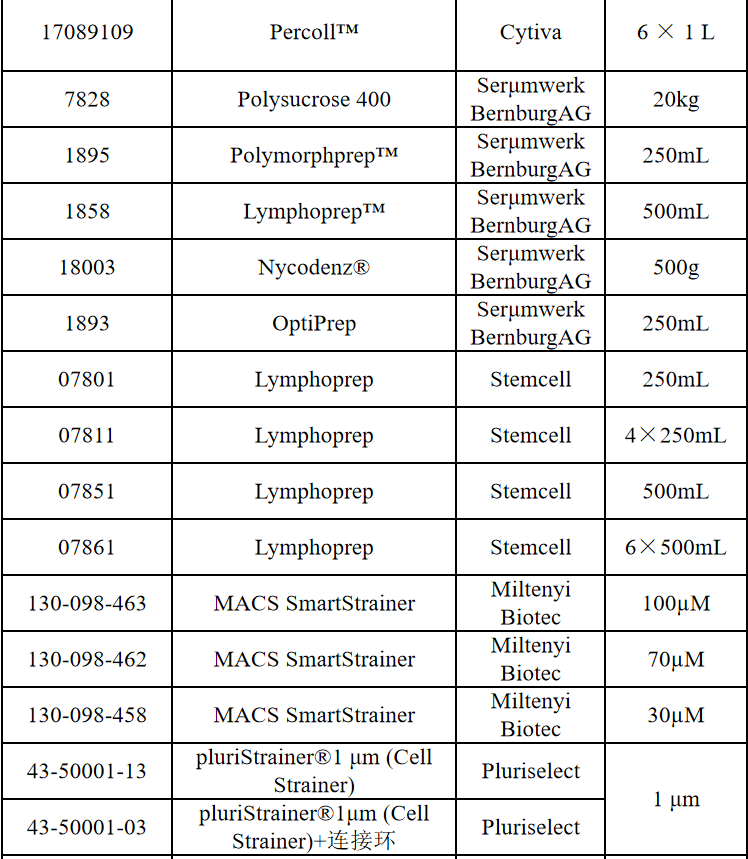
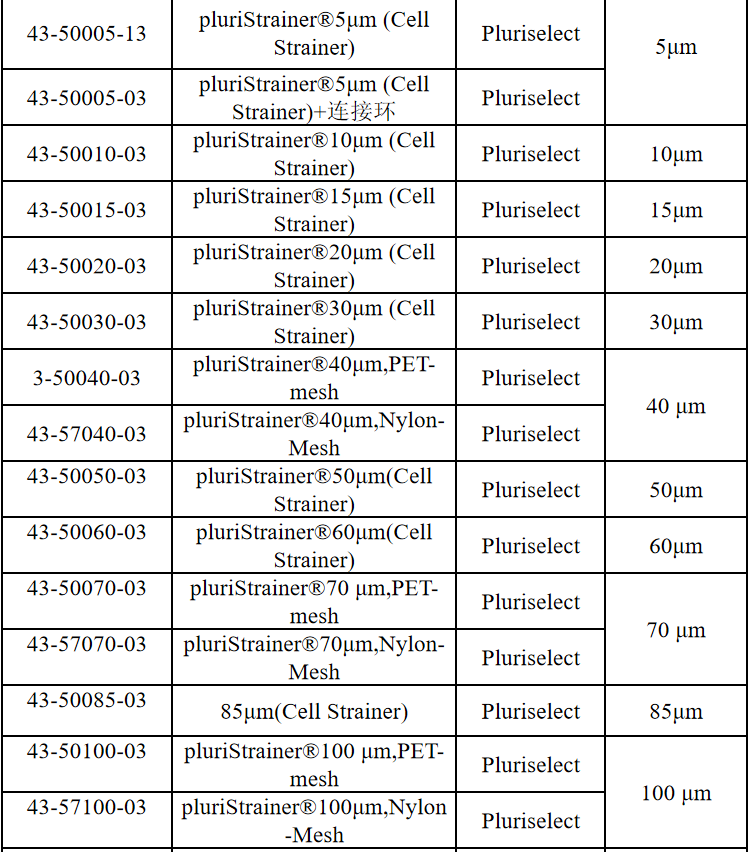

其他细胞品类
别划走,精彩继续

长按识别
添加一对一专属技术支持

扫码进群
咨询详细产品信息

点在看,传递你的品味












