【Serumwerk】精子相关细胞(Sperm-associated cells)纯化与分离
精子相关细胞分离不成功、实验做不出来怎么办?新手小白迫切求助,希望各位前辈在文章下方留言,分享自己的经验,为小白们答疑解惑!
牛精子(Bovine spermatozoa)纯化
溶液制备
A. OptiPrep™(使用前轻轻摇晃)
B. 稀释剂:Hanks 缓冲盐溶液(HBSS)或其他合适的环境温度稀释剂,如橡胶稀释剂(RD)。
试验方法
1. 评估新鲜取精的活力,然后与等体积的溶液A混合,使其密度增加到大约1.170 g/ml。
2. 准备两个梯度溶液:1.119 g/ml (4体积 OptiPrep™+ 7体积HBSS)和1.154 g/ml (9 体积 OptiPrep™+ 10体积HBSS)。使用RD mix分别为4体积+ 8体积和9体积+ 11体积。
3. 在合适的管(50 ml)中,将两种梯度溶液各10 ml分层,并将其置于10-15 ml样品- Optiprep™混合物(密度约为1.17 g/ml)的底层,以形成三步梯度。
4. 1500g离心20分钟,20℃。
5. 离心后,畸形精子,细胞质液滴,分离的头尾带在梯度的顶部。正常形态带的运动细胞在1.119/1.154 g/ml的界面,而在加载区,一个沉淀和一些悬浮的颗粒材料含有不运动的精子。然后可以检查精子细胞的活力和生育力并保存。
方法注释
1. 稀释溶液可以是任何合适的溶液。稀释部分之最终密度将端视稀释剂之密度而定。常见的生理盐溶液,如磷酸盐缓冲盐水、Hank’s缓冲盐溶液(HBSS)或更复杂的培养基如RPMI,密度接近1.005 - 1.006 g/ml。然而,使用设计用于在室温下保存精子细胞活力和活动力的培养基可能更为可取。这些所谓的环境温度稀释剂(例如Ruthin稀释剂)经常含有诸如山梨醇等多元醇并且因此具有略高的密度(ρ = 1.018 g/ml)。
2. 配制密度溶液所需的OptiPrep™和培养基的体积将随培养基的密度而变化。
3. 最近Garrett等人简化了梯度:精液(首先用Eqcellsire™稀释)与等体积的OptiPrep™混合;然后将8ml的这种悬液与1ml的1.15 g/ml溶液覆盖,并在1000 g离心15分钟。存活的精子在梯度的顶部条带。
4. 精液质量是通过膜完整性作为一般细胞功能和活力的指标来评估的。采用Revell和Mrode的渗透压抵抗试验(ORT)和Harrison和Vickers的荧光分析方法检测膜的完整性。从1.119/1.154 g/ml界面的运动带通过这些测试显示超过95%的活性,而颗粒材料和颗粒材料残留在加载层发现99%的细胞是不可活的。
5. 通常,有活力的精子在脱脂牛奶、葡萄糖和甘油中稀释,以提供1.5×107 /A.I.吸管,并进行深度冷冻。当吸管随后被解冻并进行ORT时,根据膜完整性和活性判断,74%的精子仍然有活力。
6. 其他物种的射精也显示出类似但不完全相同的条带特征:可能需要对层的精确密度进行小的改变。
啮齿动物精子(Rodent sperm)纯化
在碘克沙醇浓度为15%和24% (w/v)的双层梯度下分离活精子细胞和非活精子细胞;400 g离心20分钟后,活精子在两种碘克沙醇溶液的界面上条带。
马精子(Equine sperm)纯化
使用了两层梯度,分别为1.090和1.165 g/ml或1.090和1.170 g/ml,这些梯度可以更好地保持形态和前向运动,如果在采集后进行梯度纯化,比在冷冻保存前立即进行更有效。
非洲爪蟾精子和精子细胞(Xenopus laevis sperm and spermatids)分离
采用12%、20%和30%(w/v)碘二醇的不连续碘二醇梯度,从较密集的成熟精子液中分离出较轻的精子细胞。
优化操作——冷冻前浓缩精液
在冷却和冷冻前将精子沉淀在碘克沙醇的致密垫层上,可显著提高活精子的恢复和活力。缓冲液通常是OptiPrep™本身,离心条件从800 g 10分钟到1000 g 20分钟不等。为了获取精子带,使用一个狭窄的金属套管去除细胞上下的液体。该方法已广泛用于马精子,也见于瞪羚精液、大象精液、野猪精液、驴精液、水牛精液、猪精液、公羊精液和啮齿动物精液。碘二醇溶液可以在所有密度下与血浆进行近似等渗处理。
相关产品推荐
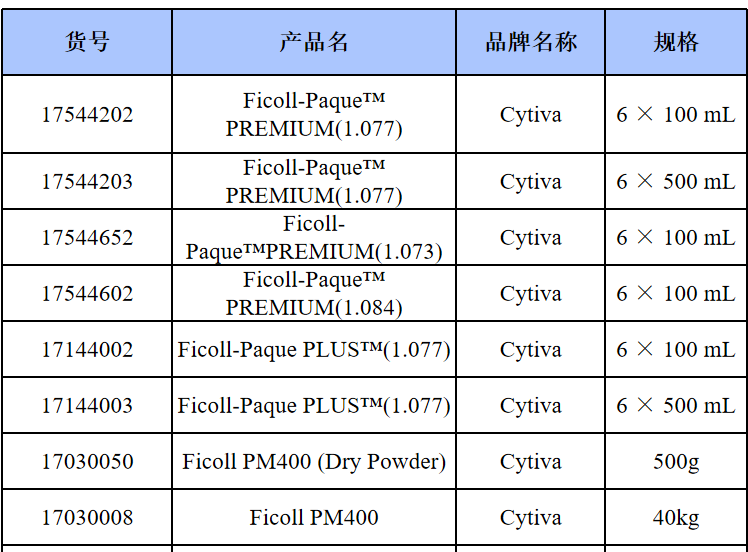
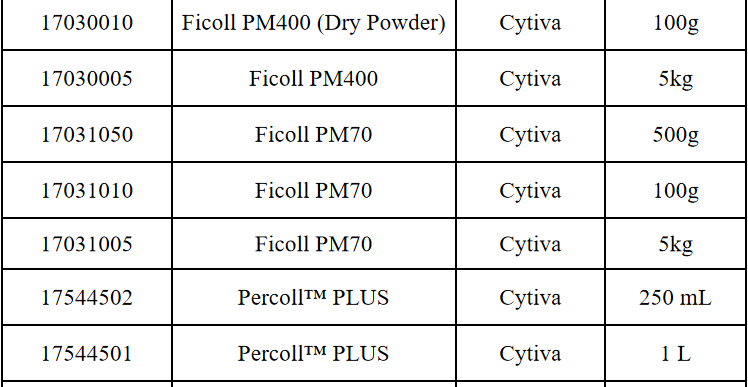
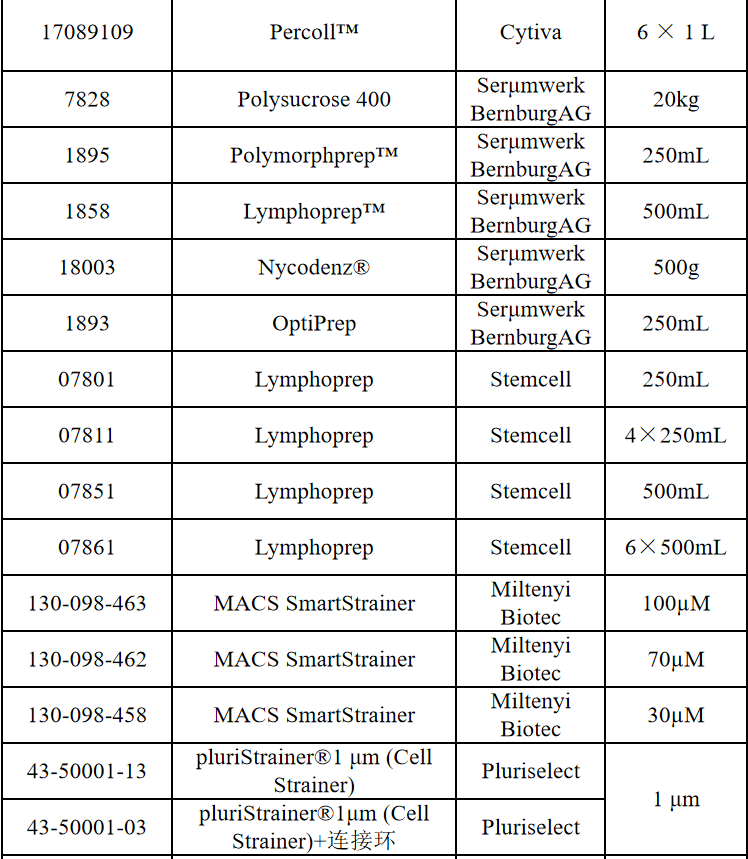
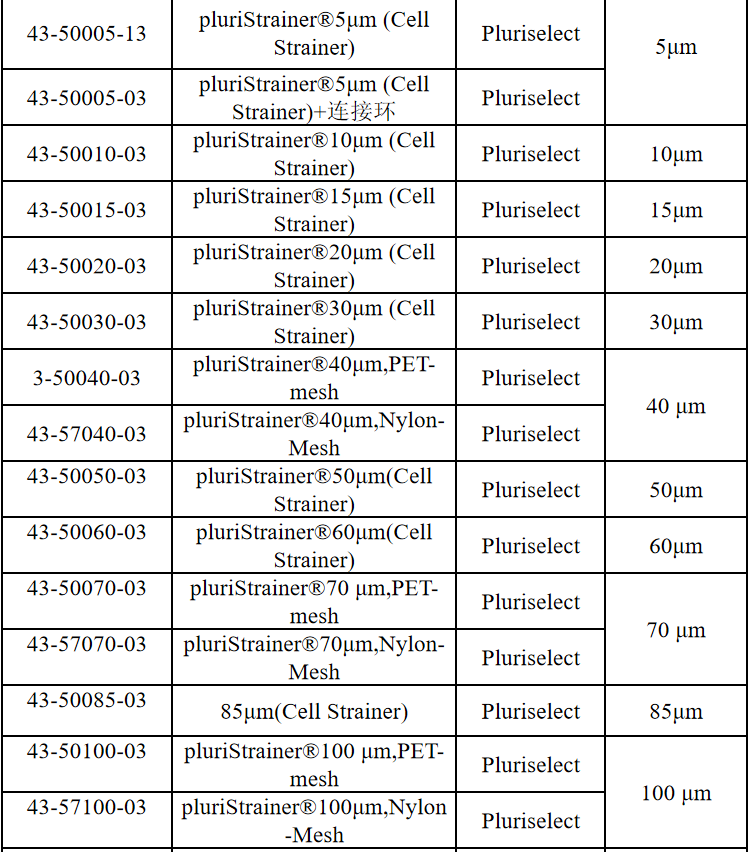

其他细胞品类
别划走,精彩继续

长按识别
添加一对一专属技术支持

扫码进群
咨询详细产品信息

点在看,传递你的品味












