【Serumwerk】树突状细胞(Dendritic cells)分离——低密度屏障浮选法
树突状细胞分离不成功、实验做不出来怎么办?新手小白迫切求助,希望各位前辈在文章下方留言,分享自己的经验,为小白们答疑解惑!
溶液制备
A. OptiPrep™(使用前轻轻摇瓶)
B. 悬浮液:Hank’s平衡盐溶液(不含Ca2+和Mg2+)
C. 稀释剂:0.88%(w/v)氯化钠,1 mM EDTA,0.5%(w/v)牛血清白蛋白(BSA),10 mM HEPES-NaOH,pH 7.4
D. 消化溶液:含5%胎牛血清(FCS)的RPMI(DMEM或IMDM),10 U/ml胶原酶
试验方法
组织分离
1. 通过解离所选组织制备单细胞悬液方案可能因实验室而异。
2. 将切碎的组织在37℃溶液D中消化两次并保持30 min。
3. 通过不锈钢筛进行消化。
4. 通过离心收集细胞,并根据需要在平衡盐培养基中洗涤细胞。
梯度分离
1. 从溶液A和C (1:4.2 v/v)配制11.5% (w/v)碘克沙醇溶液(ρ = 1.065 g/ml)。
2. 将洗涤过的细胞颗粒悬浮于溶液B中,与OptiPrep (3:1 v/v)温和但彻底混合,得到15% (w/v)碘克沙醇溶液(ρ = 1.085 g/ml)。将4 ml该悬浮液与5 ml 11.5%碘克沙醇溶液和3 ml溶液B覆盖。
3. 在室温(约20℃)下以600 g离心15 min。
4. 允许转子在没有刹车的情况下减速,并从11.5%碘克沙醇层的顶部获得直流。
方法注释
1.消化培养基的成分只作为基本配方,其他成分如抗生素;可根据操作人员的要求包括谷氨酰胺。
2.术者应使用对选定组织有效的任何消化方案。然而,重要的是,消化后对细胞的处理应尽可能轻柔,以避免对细胞的潜在损害。有时在最终的细胞悬浮培养基中包括DNase I和/或EDTA以减少任何细胞聚集。
3.这种培养基不应含有Ca2+或Mg2+,但可允许含有FCS。
4.一些出版物报告使用高于1.065 g/ml(最高1.071 g/ml)的上层密度和不同于溶液C的组合物介质来稀释OptiPrep™。
相关产品推荐
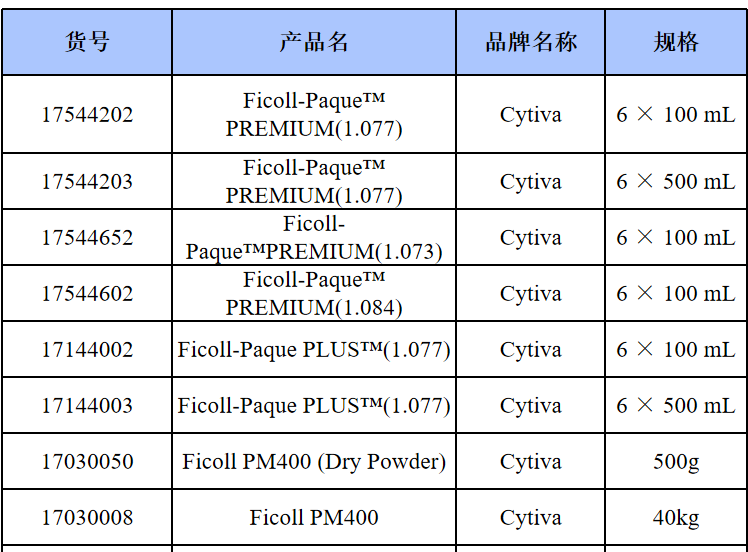
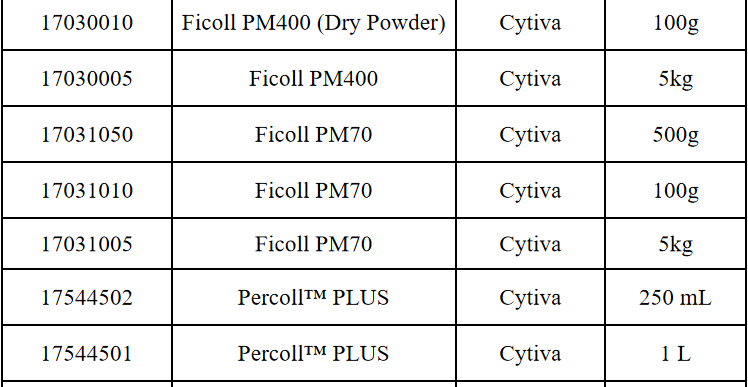
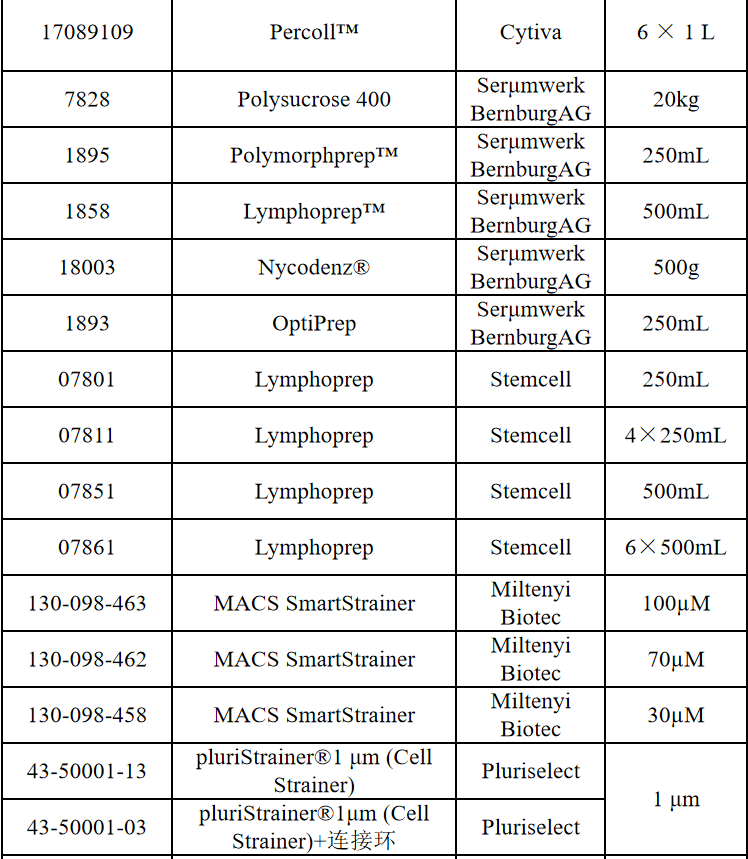
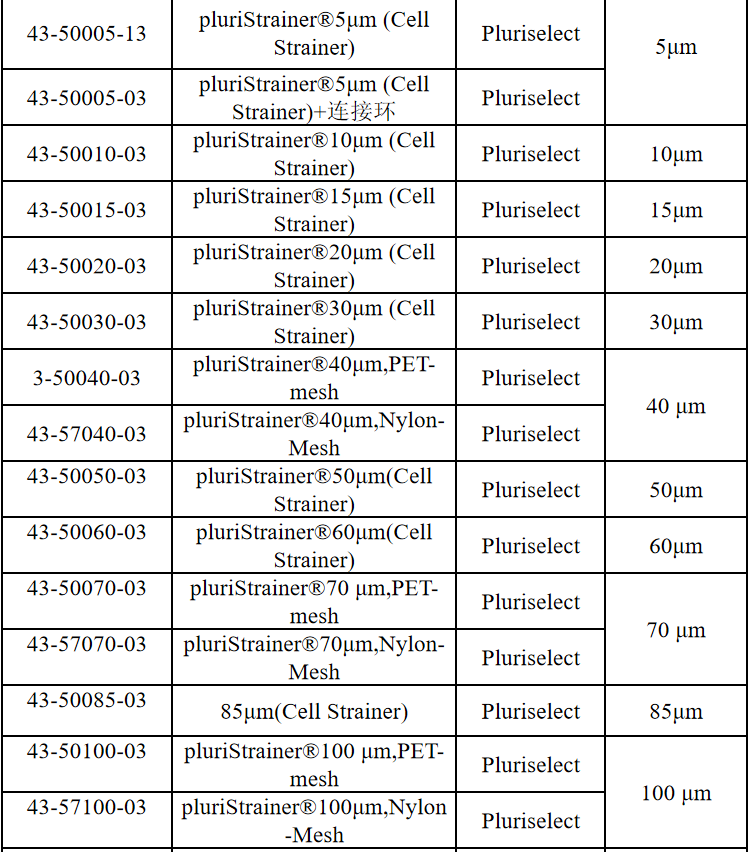

其他细胞品类
别划走,精彩继续

长按识别
添加一对一专属技术支持

扫码进群
咨询详细产品信息

点在看,传递你的品味












