【Wako】蛋白定量试剂的选择方法
即使为同一目的所用的试剂种类繁多,同一物质也会有不同的浓度、纯度、规格。
因此,经常有研究人员向我们问到“不知道哪一种适合自己的实验”等。
为了解决这样的问题,我们将介绍一些正确区分使用FUJIFILM Wako品牌试剂的方法。
蛋白定量试剂
在Western blotting或ELISA中,比较样品之间的蛋白表达水平时,需要评估总蛋白量。蛋白的定量方法有许多种,但需要从检测灵敏度、检测时间以及在表面活性剂和还原剂等条件下是否可检测等角度来选择合适的定量试剂和方法。
Bradford法(Bradford assay)
CBB G-250能与蛋白质的碱性氨基酸残基、N末端氨基酸以及芳香族氨基酸形成非共价键,最大吸收波长由465 nm变为595 nm。可通过测定595 nm处的吸光度变化来定量蛋白。
Lowry法(Lowry protein assay)
在碱性条件下,向蛋白溶液中加入双缩脲(Biuret )试剂后,双缩脲试剂中存在的Cu(II)与蛋白形成络合物。随后添加Folin-Ciocalteu试剂,通过色氨酸、酪氨酸和半胱氨酸,使磷钨酸和磷钼酸被还原,蛋白溶液呈现蓝色。可通过测定750 nm处的吸光度来定量蛋白。
BCA法(Bicinchoninic acid assay)
Lowry法的改良方法。在碱性条件下,Cu(II)与蛋白形成络合物,色氨酸、酪氨酸、半胱氨酸将Cu(II)还原为Cu(I)。向Cu(I)中添加二辛可宁酸(Bicinchoninic Acid),形成在562 nm处呈现出强波长吸收性的深紫色络合物。通过测定此时的吸光度来定量蛋白。
邻苯三酚红·钼络合物法、
(Pyrogallol red-molybdenum assay)
邻苯三酚红和钼(VI)结合,形成最大吸收波长为470 nm的络合物。在酸性条件下,络合物与蛋白的结合使其最大吸收波长变成约600 nm1)。可通过测定600 nm处的吸光度来定量蛋白。

参考文献
1)渡辺信⼦,⻲井幸⼦,⼤久保昭⾏,⼭中學: 臨床検査, 30(7), 778(1986).
2)鈴⽊祥夫: ぶんせき,1,1(2018).
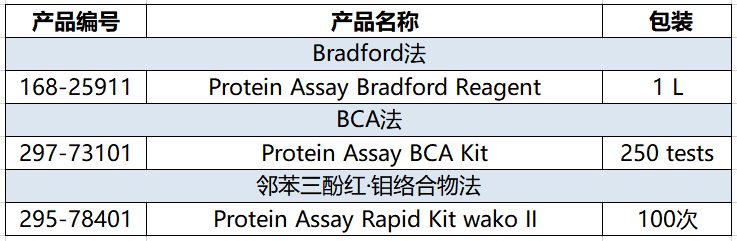
产品列表
※ 仅供实验研究用,不可用于临床诊断。
点在看,传递你的品味