【Serumwerk】副黏病毒科(Paramyxoviridae)纯化
副黏病毒科纯化不成功、实验做不出来怎么办?新手小白迫切求助,希望各位前辈在文章下方留言,分享自己的经验,为小白们答疑解惑!
麻疹病毒(Measles virus)纯化
试验方法
Hallek等纯化的麻疹病毒,在Vero细胞中生长;在细胞溶解后,将含病毒的液体以1,500 g澄清10 min,上清液应用于6-36% (w/v)碘克沙醇连续梯度,200,000 g离心2h。
Brindley和Plemper还在Vero细胞中培养病毒,在100 mM NaCl、1 mM EDTA、10 mM Tris-HCl中溶解细胞后,在5000 g下澄清裂解产物,在4℃下保持20 min,以使细胞核和细胞碎片颗粒化。在裂解缓冲液中制备10%和30% (w/v)碘克沙醇的两种溶液并用于制备不连续梯度。在将裂解产物装入顶部后,以100,000 g离心90 min。以最小液体量从界面收获浓缩病毒,然后以连续的10%-30% (w/v)碘克沙醇梯度加载,并以100,000 g离心14 h。所有操作均在4℃下进行。梯度以等体积分数收集并分析。
Liljeroos等人也使用不连续梯度来浓缩病毒。Iodixanol解决方案准备使用三羟甲基氨基甲烷缓冲液180毫米氯化钠(EDTA)和病毒沉淀在了2毫升54% (w / v) Iodixanol垫通过一层8毫升的20% (w / v) Iodixanol离心134000 g 4 h。收获的条带用缓冲盐水稀释,在Amicon旋转柱中浓缩,然后加载到15%、25%、35%和54%(w/v)碘二醇的第二次不连续梯度上,并以相同的速度离心约15小时。
方法注释
1.当病毒在两层碘克沙醇的交界面被结合,并随后被覆盖到第二个类似的梯度上时,在收集结合材料时必须非常小心,以避免清除过多的致密层。此可借由先移除较高密度层之大部分,然后移除低密度层之大部分来促进。
2.虽然可以通过超滤来稀释和减少收获的体积,以便在第二个梯度上重新装入低密度介质,但一个有用的替代方案是通过浮选进行第二个梯度。将试样调整为较高密度并加载于第二不连续或连续梯度的底部。
新城疫病毒(Newcastle disease virus)纯化
Biswas等人使用10-26% (w/v)碘克沙醇连续梯度,在80000g离心2小时的情况下研究了NDV和人血清之间的相互作用。根据沉降速率的不同,梯度中的分离可能包含一定程度的分辨率。融合蛋白和基质蛋白向梯度中部和人血清方向条带,导致蛋白发生小的高密度转移,并在梯度底部出现大量聚集的病毒。补体C3组分分布较广,也在梯度的中间,融合蛋白和基质蛋白重叠,但未出现在非常密集的区域。在没有病毒的情况下,这些补体蛋白仅在低密度区条带。
猪副粘病毒(Pig paramyxovirus)纯化
两种猪副黏病毒已在14-26 (w/v)碘克沙醇梯度中纯化,该梯度是通过用PBS稀释OptiPrep™制备的。将细胞裂解物在梯度上方分层,并在摇桶转子中以250,000 g离心1.5 h。未说明病毒的显带密度。
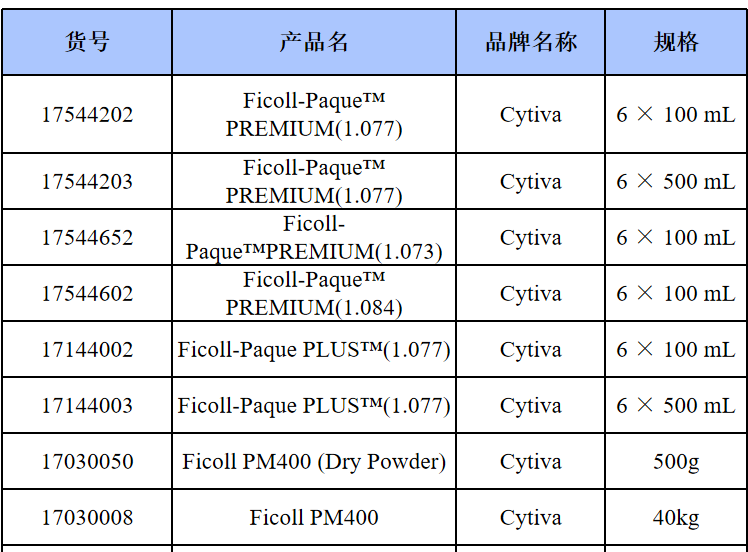
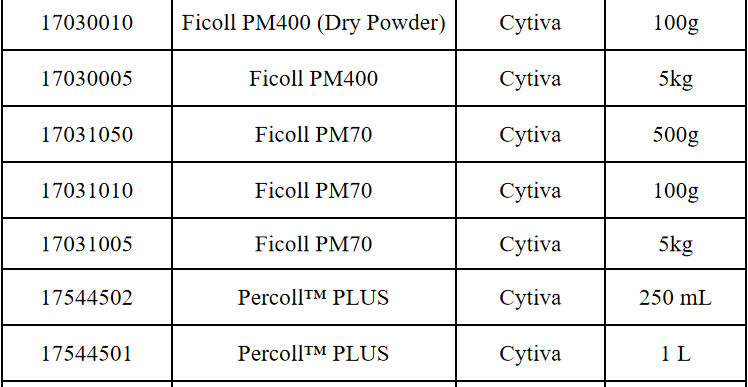
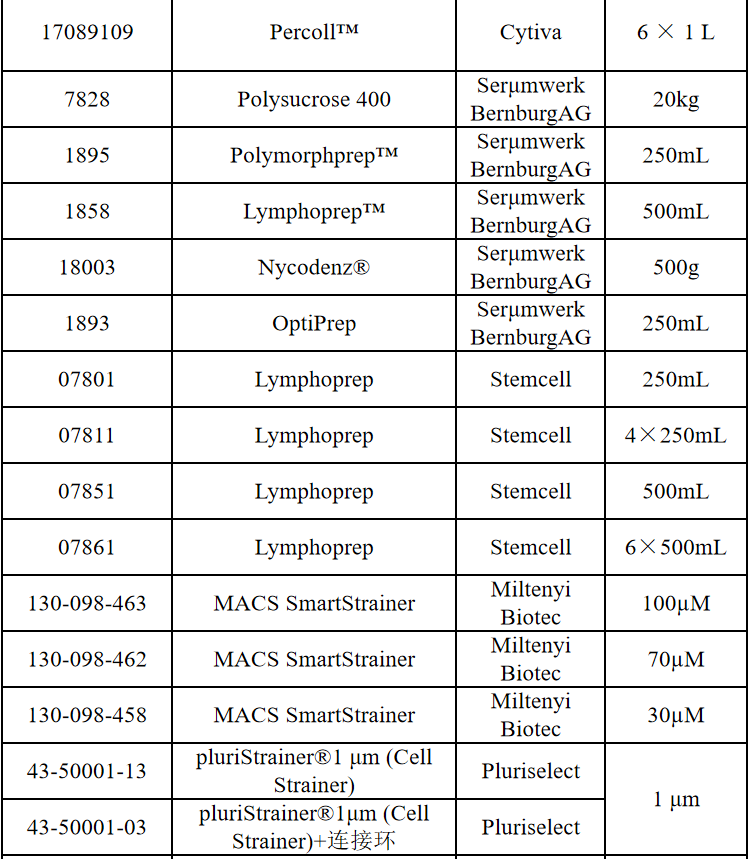
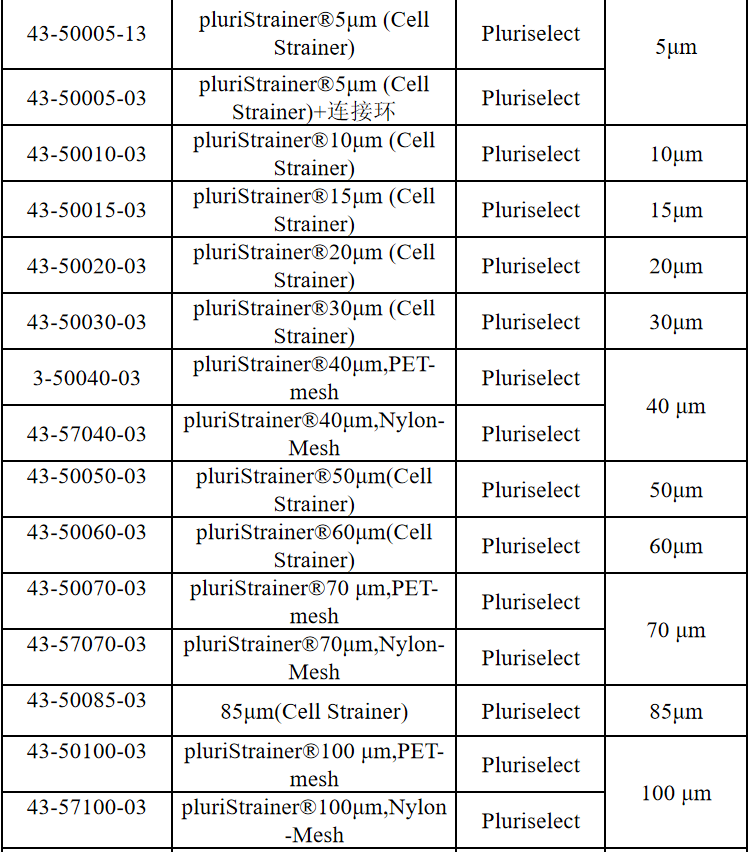
相关产品推荐
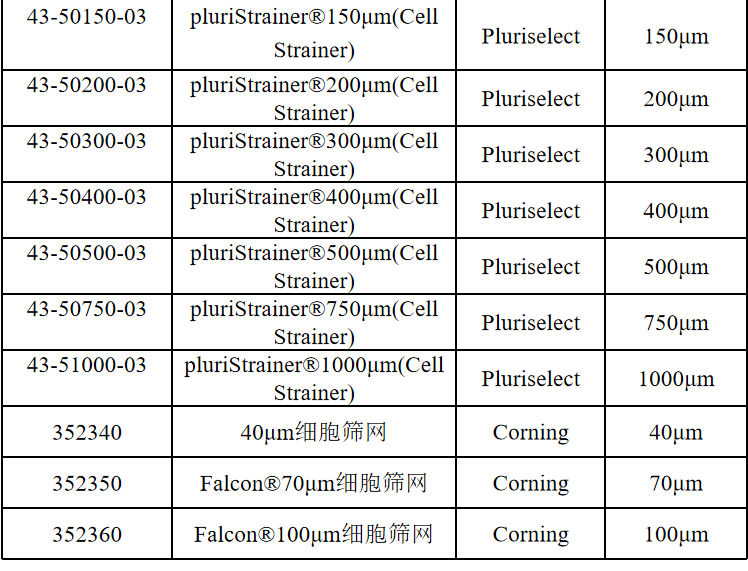
其他细胞品类
别划走,精彩继续

长按识别
添加一对一专属技术支持

扫码进群
咨询详细产品信息

点在看,传递你的品味












