【Serumwerk】腺病毒和辅助病毒科(Adenovirus and helper virus families)纯化
腺病毒和辅助病毒科纯化不成功、实验做不出来怎么办?新手小白迫切求助,希望各位前辈在文章下方留言,分享自己的经验,为小白们答疑解惑!
溶液制备
A. OptiPrep™
B. 10x磷酸盐缓冲盐水,含10 mM MgCl2和25 mM KCl (10xPBS-MK)
C. 含1 mM MgCl2和2.5 mM KCl的磷酸盐缓冲盐水(PBS-MK)
D. 2 M氯化钠溶液
E. PBS-MK中54% (w/v)碘克沙醇工作液:将9体积OptiPrep与1体积溶液B混合。
准备以下梯度溶液:
15% (w/v)碘克沙醇含1 M NaCl在PBS-MK: 1.5体积的溶液E + 2.7体积的溶液D + 1.2体积的溶液C
25% (w/v)碘克沙醇在PBS-MK: 2.5体积的溶液E + 2.9体积的溶液C
40% (w/v)碘克沙醇在PBS-MK: 4.0体积的溶液E + 1.4体积的溶液C。
试验方法
1.通过4次冻融循环破坏含病毒细胞:将细胞快速冷冻于液氮或干冰-甲醇中;在室温下解冻,然后将悬浮液涡旋两次30秒,每次涡旋之间在冰上停留15秒。
2.通过2000 g离心10 min使细胞裂解液澄清。
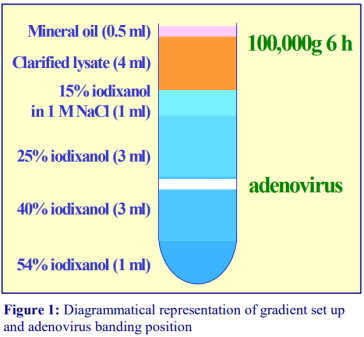
3.在4 ml澄清裂解液中加入1 ml 15%碘克沙醇;3 ml 25%碘克沙醇、3 ml 40%碘克沙醇和1 ml 54%碘克沙醇工作液。
4.在试管顶部填充少量低密度矿物油,在4℃下以100,000 g离心6-16小时。
5.要么先收集1 ml的整个梯度,要么使用注射器(连接22号针),直接去除0.5-1.0 ml的条带。
方法注释
1.Arpiainen等人使用15%,30%和40% (w/v)碘克沙醇的改良梯度,在4℃ 100,000 g离心14-16小时。
2.对于较大或较小体积的管,按比例放大或缩小层和样品的体积。Peng等使用6.5 ml澄清的裂解液,15%、25%和40%碘克沙醇溶液各2 ml和54%碘克沙醇0.5 ml。
3.Peng等人通过对样本进行分层,从最密集的溶液开始创建梯度。这与通常的底层策略相反(即从最不密集的解决方案开始)。
4.10万g的最低要求是6小时。虽然许多摇斗转子能够承受较大的g力,但这种相对较低的g力可能会使病毒颗粒在第一个界面的聚集最小化。
5.可溶性蛋白在25%碘克沙醇层中广泛分布,离心6小时比离心16小时可减少对腺病毒带的侵占。
6.腺病毒条带位于40%碘克沙醇层的顶部,有时呈双重条带。裂解产物中所有的污染蛋白均广泛存在于25%碘克沙醇中,并可能到达25%/40%碘克沙醇界面。
7.Peng等人使用约200,000 g仅作用1小时。在这些条件下,腺病毒条带出现在25%/40%的界面。
在许多情况下,在进一步处理样品之前不需要去除碘克沙醇。然而,如果有任何下游程序的要求,尺寸排阻色谱法通常是首选的方法。
从辅助病毒中分离辅助病毒依赖的腺病毒载体
将病毒悬液调整为38.7% (w/v)碘克沙醇并在4℃垂直旋翼中以180,000 g离心(在约13 ml管中)3 h。辅助病毒(HV)在碘克沙醇浓度为40.3 ~ 41.6%时出现条带,腺病毒载体(HDV)在碘克沙醇浓度为37.6 ~ 39.4%时出现条带。通过粒径排阻色谱去除碘克沙醇。
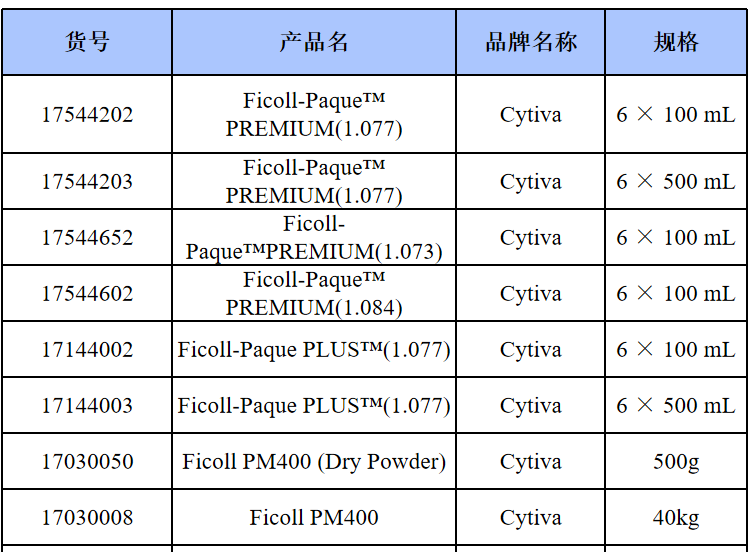
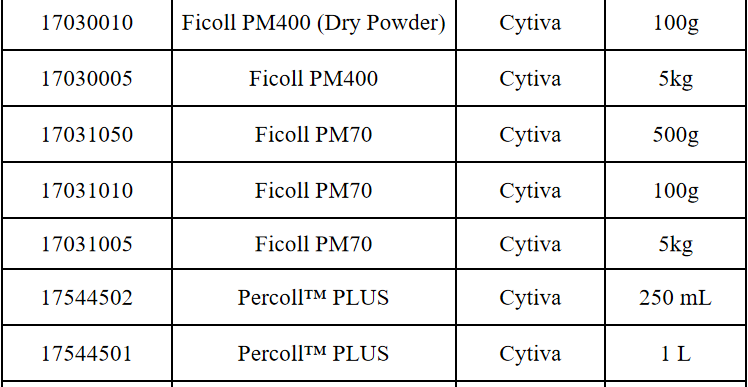
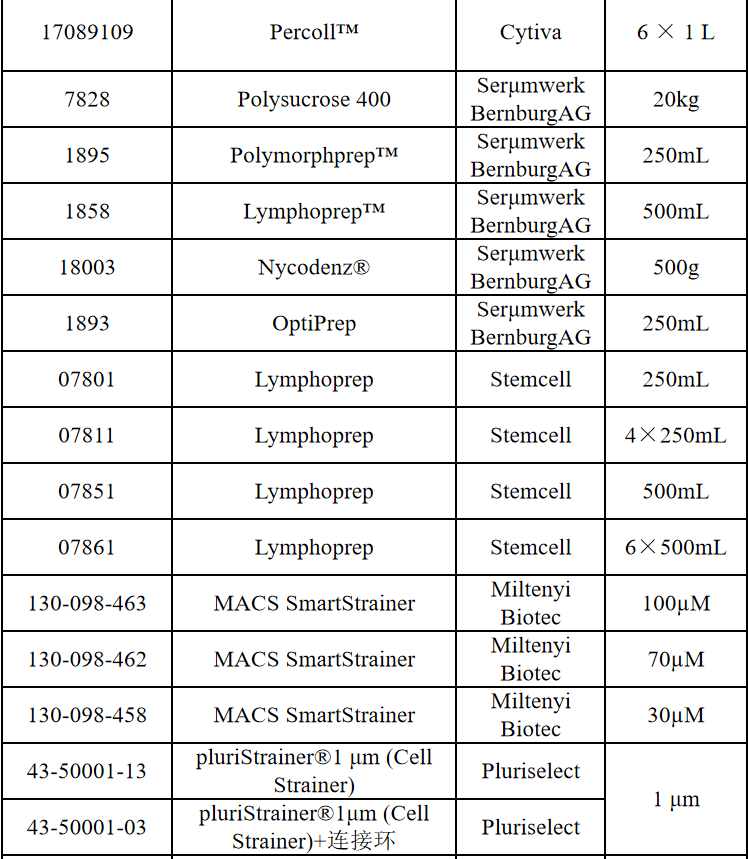
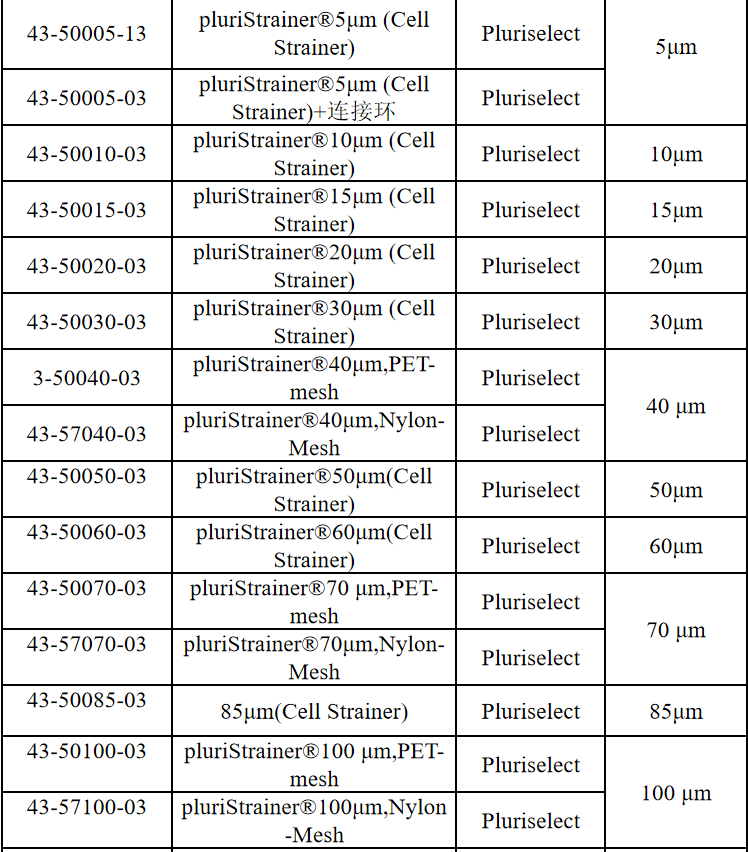
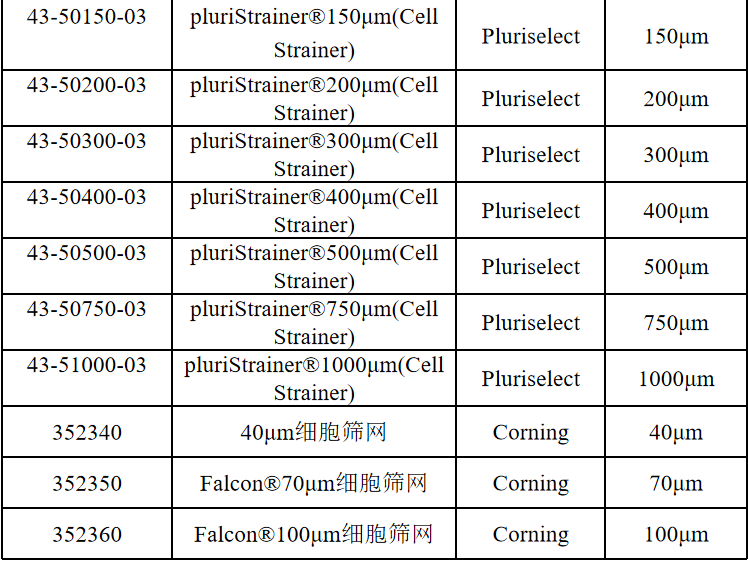
相关产品推荐
其他细胞品类
别划走,精彩继续

长按识别
添加一对一专属技术支持

扫码进群
咨询详细产品信息

点在看,传递你的品味












