【Merck】Cell-in-a-Box® 细胞封装技术
原理简介
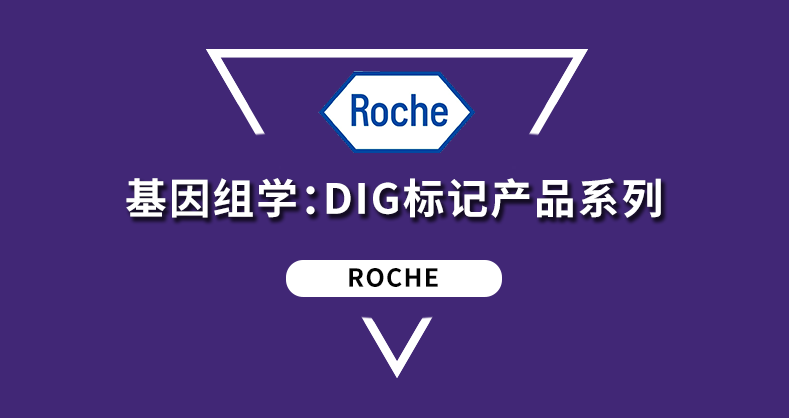
Cell-in-a-Box® 技术是将活细胞包裹进直径0.7~2 mm的小球内,为活细胞提供保护屏障和3D培养环境,常用于活细胞的培养、分离、低温保存和转运等。包裹材料基于生物内源性的纤维素,球上小孔的口径仅允许养分、分泌物、抗体大小的蛋白产物等自由出入,从而保护细胞不受污染、不引起免疫排斥,具有良好的生物安全性。
Cell-in-a-Box® 技术特点:
• 半通透性:仅允许养分/产物等出入
• 全面保护:提高细胞活力,延长细胞寿命
• 可持续性:包装的细胞可在动物体内保留数年
• 生物兼容:适合多种细胞类型,体内实验更安全
• 生物内源性材料:无毒、环保,体内应用不引起免疫排斥
• 突破性专利技术:包装的细胞可培养、冻存、液氮运输等
操作指南
Cell-in-a-Box® 细胞封装方法
Cell-in-a-Box® 细胞封装试剂盒以专有的封装材料和方法为基础,任何使用者都可通过这一操作简单的一次性系统手动完成。
该封装组分无毒性且具有生物相容性。小球可将细胞稳稳地包裹在囊腔内,同时允许细胞在限定边界内继续生长。营养成份和分泌因子可通过膜孔进行扩散和交换,而膜孔也可根据需要进行调整。其操作简单、快速,仅需30min。
一、试剂耗材准备
Cell-in-a-Box® 细胞封装试剂盒(货号:CIB001)
▪250 ml烧杯(无菌),带磁力搅拌棒
▪ 磁扰动器板
▪ 无菌PBS ≥500 ml(不含Ca2+或Mg2+)
▪ 无菌水 (≥100 ml)
▪ 电子计时器
▪ 微量离心管和圆锥管
▪ 血清移液管(2、5、10、25和50 ml),带自动移液吸头
▪ 移液管和无菌过滤移液管吸头 (1 ml)
▪ 无菌培养瓶或板
▪ 选配—用于处理小球(胶囊)的刮刀
▪ 选配—其他容量规格的鲁尔锁注射器
二、实验步骤
大多数类型的细胞都适合封装。贴壁细胞可根据标准细胞培养方案从细胞培养皿中分离并通过离心法获取。而悬浮细胞可直接采用离心操作。初始细胞密度为5×105至5×106细胞/ml的溶液1适用于封装。建议以溶液12×106细胞/ml的细胞密度作为起始点并用于该过程。密度可根据细胞类型进行调整(见附录)。本试剂盒包含5ml溶液1,足够进行5次单独封装实验。每次封装的最低推荐量为1ml,共可生成120个胶囊。由于液滴加样的时间限制为1分钟,因此胶囊的产量取决于液滴加样的速度,而并非所用溶液1的体积。
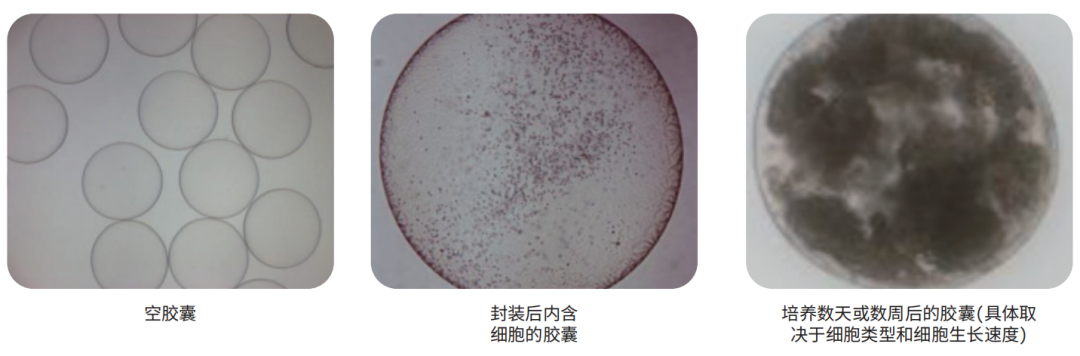
将细胞与溶液1混合,并滴至溶液2,同时不断搅拌,作为硬化槽。当液滴硬化为胶囊后,需执行一系列清洗步骤,然后将封装细胞转移至生长培养基中。大多数细胞将会聚集或增殖以移生至胶囊内并在大多数情况下将胶囊填满(见下面结果图)。可通过常规代谢活性测定法来监测生长情况,例如刃天青等。
注:确保所有必需材料均已事先备好(请参见所需但未提供的试剂和设备)。尽可能对所有材料进行高压灭菌和消毒,并在使用前将所有培养基加热至室温状态。
始终采用无菌技术在无菌条件下的层流净化罩中操作。
1.在层流罩中备好搅拌板和烧瓶。
2. 首先,使用移液管将90ml的水移至250ml的烧瓶中。然后加入10 ml溶液2。在硬化槽中冲洗移液管。搅拌10分钟。降低搅拌棒速度至最低实践搅拌速度以便于封装。
3. 根据实验室操作步骤制备细胞的单细胞悬浮液(也可采用说明书附录中概述的方法)。
4. 使用PBS清洗细胞两次并计数。取2×106个细胞,并置于1.5 ml无菌微量离心管中。采用离心法制粒5分钟,然后丢弃上清液。
5. 将1ml溶液1加入细胞团块,通过上下移液使其重新悬浮于溶液中,直到细胞均匀分散。避免形成气泡。
6. 将红色塑料灌装针(G18½,钝端)连接至1ml鲁尔锁注射器上,抽取细胞悬浮液。避免形成气泡。
7. 将灌装针替换成绿色塑料液滴针(G34,钝端),特别注意将针头拧紧到位。清除注射器中的气泡。挤掉前面几滴,以排空针头中的空气。
8.打开计时器。将液滴针垂直悬放在硬化槽上方2-3厘米处。针尖不能接触槽中的液体。以1-2滴/秒的中等速度加样液滴,保持相同的滴落高度。稍微移动针头,以防止液滴每次都落在槽中的相同位置。
9. 以相同的操作继续制备所需胶囊,1分钟后停止加注液滴。
注:如需更多胶囊,使用剩余细胞悬浮液和新的硬化槽重复上述步骤。
10.加样完最后一滴液滴后,搅拌胶囊5分钟。调整搅拌器的速度,以确保胶囊在槽中不停移动。
11.停止搅拌器,并静置胶囊。使用血清移液管移走50ml槽内溶液,然后将100ml无菌PBS倒入烧杯中。
12.再次搅拌,清洗胶囊10分钟。
13.弃去100ml槽内溶液并将100ml新配制的无菌PBS加入烧杯。再清洗5分钟。
14.弃去剩余PBS,使剩余液体覆盖所有胶囊即可。
15.使用30ml PBS冲洗3次,然后使用30ml细胞培养液再冲洗3次。加入30ml液体冲洗并使用移液管将其移除视为一个冲洗循环。
16.使用25ml血清移液管取出胶囊成分。将其放入容器或烧瓶中。加入适量细胞培养液,以维护封装细胞。
17.将烧瓶置于CO2培养箱中培养,并定期更换培养基(例如,每周2-3次),以保持封装细胞的活性。
注:为了能够从注射器中残留的细胞-溶液1悬浮液中制备更多胶囊,根据步骤2准备新的硬化槽,并从步骤8开始重复操作。使用后,请小心处置用过的针头。
三、结果
四、附录
封装参数的计算和调整
1.通过以下公式计算必要数量:

其中:
VSol1=重悬细胞并制备液滴所需的溶液1体积
Vcell-PBS=封装步骤所需的PBS细胞悬液体积
Ccell-Sol1=溶液1中所需的细胞封装起始浓度
Ccell-PBS=根据经验计算的细胞PBS悬液细胞浓度
2.为细胞选择所需封装密度(Ccell-Sol1)。 初始细胞密度为5×105至5×106细胞/ml的溶液1适用于封装。建议溶液1的初始密度为2×106个细胞/ml并用于该过程。
3. 选择适当体积的溶液1(VSol1)待用。在大多数情况下,建议最小体积为1ml,可生成大约150粒胶囊。根据胶囊数量相应调整体。
4. 从细胞-PBS悬浮液中抽取所需体积的细胞(Vcell-PBS)并制粒,然后移除上清液。
5. 抽取所需细胞-PBS悬液(Vcell-PBS)并200–500×g离心沉淀。丢弃PBS上清液。
6. 加样细胞团块,然后加入所需体积的溶液1(Vcell-Sol1)。继续执行步骤7。
示例1:
假如活细胞密度(Ccell-PBS)为1.60×106细胞/ml,现有10ml细胞-PBS悬液,若要使用1ml溶液1(VSol1)以2×106细胞/ml(Ccell-Sol1)的细胞密度封装细胞,则:
(Vcell-PBS) = 1.25 ml
取1.25ml的10 ml细胞-PBS悬液进行沉淀。
示例2:
假如计算的活细胞密度(Ccell-PBS)为0.40×106细胞/ml,现有2ml细胞-PBS悬浮液,若要以1×106细胞/ml(Ccell-Sol1)的细胞密度封装,则:
(Vcell-PBS) = 2.5 ml
在这种情况下,将需要2.5 ml细胞-PBS悬浮液,但现在只有2ml,溶液量不够。因此,必须使用全部细胞-PBS溶液 (2ml)。此时需要减少溶液1体积以保持相同的封装浓度(Ccell-Sol1)。为此:使用全部细胞-PBS悬浮液,沉淀获得0.8×106细胞,然后使用0.8 ml的溶液1重悬。
单细胞悬液制备和细胞计数
1. 对于贴壁细胞系,将3 ml胰蛋白酶溶液加入单个T175烧瓶的融合细胞中以分离细胞。然后,加入7ml含10% FBS或类似物的细胞培养液,使胰蛋白酶失活。用移液管上下吹打分解细胞团块。
2. 对于悬浮细胞系,执行步骤3。
3. 将单细胞悬浮液移入50 ml离心管,200–500×g(细胞特定)离心5分钟。
4. 丢弃上清液,轻轻摇晃试管使细胞团块松脱。
5. 在40ml PBS溶液中重悬细胞以便洗涤。
6. 再次200–500×g沉淀细胞5分钟,然后再次采用10-40 ml PBS溶液[Vcell-PBS ]重悬(以在计数期间调整细胞浓度)。
7. 采用标准实验室方法(例如,可选用细胞计数板、台盼蓝计数法)计数悬浮液中的细胞数量。
其他细胞品类
别划走,精彩继续

长按识别
添加一对一专属技术支持

扫码进群
咨询详细产品信息

点在看,传递你的品味