外泌体再生医学的实现之路
富士胶片和光纯药株式会社 生命科学研究所
丸谷祐树、山根昌之
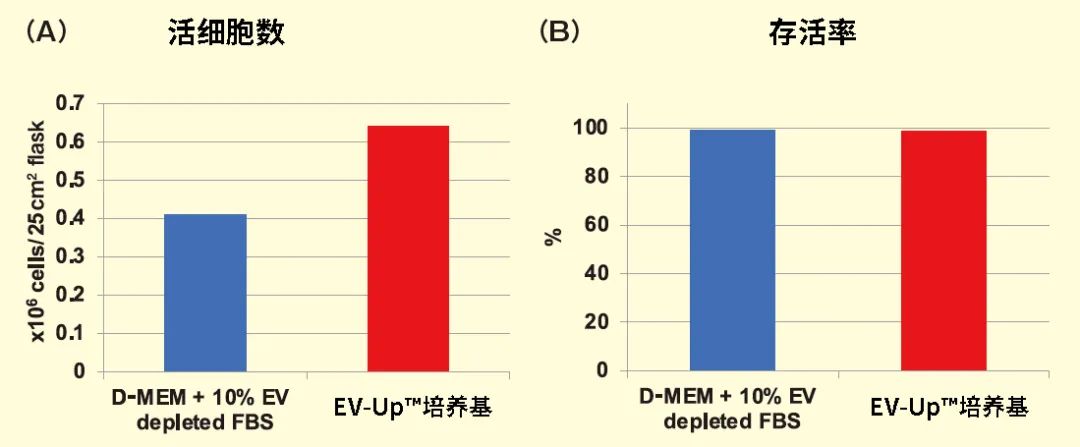
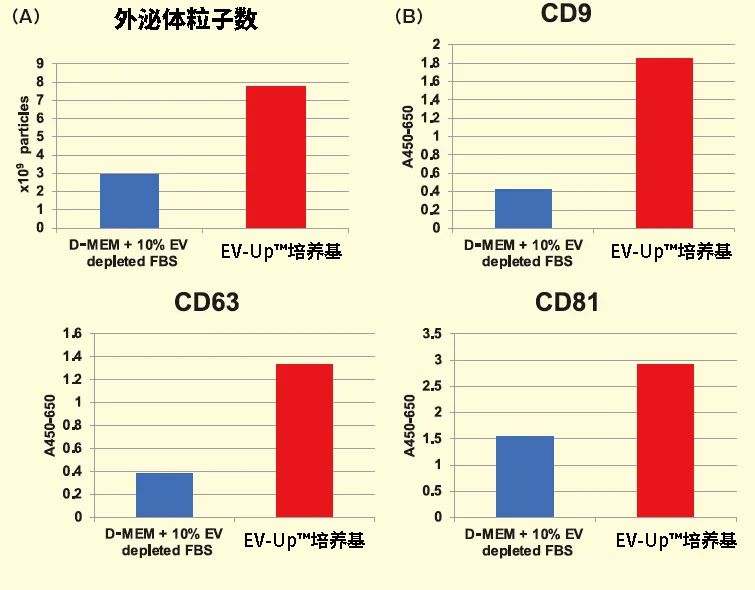
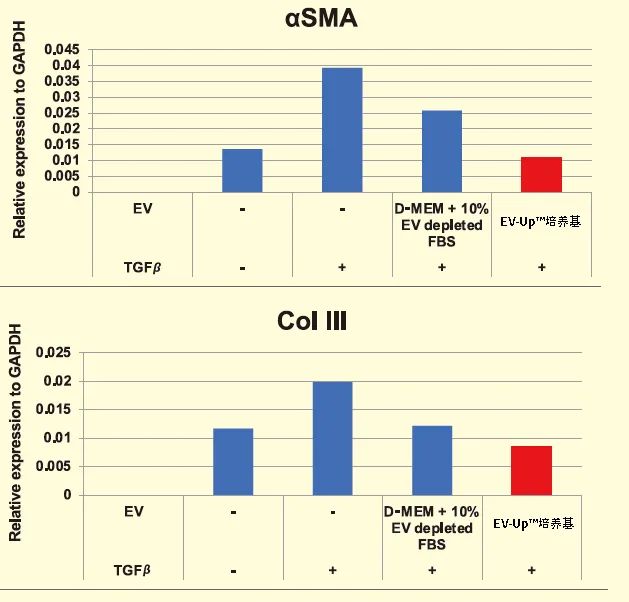
细胞外囊泡(Extracellular vesicle : EV)是由细胞释放的脂质双分子层包被的膜囊泡,作为细胞间的通讯工具发挥作用。外泌体属于EV的一种,被认为参与多种生物功能的控制,并有望用作疾病生物标记物或治疗制剂。在治疗制剂的应用方面,具有抗炎和抗纤维化作用的间充质干细胞(Mesenchymal stem cell:MSC)来源外泌体备受瞩目,其未来的实用性被寄予厚望。对MSC来源外泌体实际应用的期望不断提升,同时外泌体作为治疗制剂的生产技术研发也在积极进行。本文将介绍由FUJIFILM Wako自主研发的无血清培养基,在生产用于治疗的MSC来源外泌体方面的实用性。以CD9、CD63和CD81等作为标记蛋白的外泌体,由细胞释放的、直径在30-100 nm左右的脂质双分子层包被的膜囊泡,含有蛋白、核酸(DNA、mRNA、miRNA)、脂质等细胞来源成分1,2) 。另外,MSC来源于中胚层的成体干细胞,能够从骨髓、脂肪、脐带等组织中建立,具有分化为脂肪、骨骼和软骨的功能。除此之外,MSC还具有诱导抗炎、抗纤维化或免疫抑制等旁分泌效应,近年来有人提出这些作用是由外泌体引起的3) 。在此背景下,将MSC来源外泌体作为治疗制剂的关注度急剧攀升。关于在产生MSC来源外泌体时所用的培养基,起初使用的是几种添加了不含牛来源外泌体的胎牛血清(EV-depleted FBS)的基础培养基4,5)。然而,这些组分均以维持MSC存活为目的,能够优化外泌体分泌和生物活性效果的组分尚未研发成功。为此我们研发了一款可为MSC产生外泌体提供适宜的环境的无血清、无动物培养基,即为可同时维持高性能和高生物活性的EV-Up™基础培养基及补充剂(下称EV-Up™培养基)。▍▏使用EV-Up™培养基培养获得的外泌体产量及活性EV-Up™培养基的推荐使用方法是,在任意的增殖培养基中培养至80-90%汇合,然后更换培养基并培养 3-5 天(图1)。从血清培养基更换为无血清培养基时,多数情况下都需要进行驯化操作,但在含FBS的血清培养基中增殖的细胞,也能够直接更换EV-Up™培养基培养。在任意的增殖培养基中培养至80-90%汇合后,更换至EV-Up™培养基。然后培养 3-5 天,回收培养上清。可以通过PS亲和法从回收的培养上清液中回收外泌体。在血清培养基中使骨髓来源的MSC增殖,然后更换至含EV-depleted FBS的基础培养基或EV-Up™培养基中,检测培养5天后的细胞数和细胞生存率。结果显示,细胞数和细胞生存率均维持在较高的状态下(图2 – A、B)。图2. 使用EV-Up™培养基培养MSC的细胞生存率更换至EV-Up™培养基5天后,测得的细胞数(A)和细胞生存率(B)。接着,利用纳米粒子追踪分析法(NTA)比较使用PS亲和法纯化的外泌体粒子数6)。结果表明,使用EV-Up™培养基获得的外泌体,其粒子数约为使用含EV-depleted FBS的基础培养基的2.6倍(图3A)。进一步通过基于PS亲和法外泌体定量技术的PS ELISA比较外泌体产量,可确认和粒子数一样,外泌体标记蛋白CD9、CD63 和CD81都有所增加6,7)(图3 B)。图3. 比较使用EV-Up™培养基培养后的外泌体粒子数及外泌体标记蛋白从各培养基中取培养上清1 mL,通过NTA比较获得的外泌体粒子数(A)以及通过PS ELISA分析外泌体标记的结果(B)。最后,评估对人胎肺来源正常成纤维细胞(TIG3)的纤维化抑制效果,以比较在各培养基中培养的MSC来源外泌体的生物活性。结果表明,相比常规使用的基础培养基和含EV-depleted FBS的培养基,采用EV-Up™培养基培养的MSC来源外泌体具有更好的抗纤维化效果(图4)。图4. 比较使用EV-Up™培养基培养后的外泌体生物活性(抗纤维化活性)向TGFβ刺激的人胎儿肺源性成纤维细胞(TIG3细胞)中添加PS亲和法纯化的外泌体5×108 particles/mL,
利用Real-Time PCR法定量纤维化标记(αSMA,Collagen Ⅲ)的基因表达,比较抗纤维化活性。
以上结果显示,EV-Up™培养基可以高产量制备维持高生物活性的MSC来源外泌体,是一款创新性的培养基。此次我们研发的EV-Up ™培养基是针对MSC优化的无血清、无动物来源的外泌体生产用培养基,不仅能提升高活性外泌体的产量,因其无血清、非动物源,还可能有助于提高治疗制剂开发过程中的质量稳定性。今后使用外泌体作为治疗制剂的应用化将会在世界范围内不断发展,期待我们研发的培养基作为实用的生产技术工具得到广泛运用。1)Colombo, M. et al. : Annu. Rev. Cell Dev. Biol., 30, 255(2014).
2)Mathieu, M. et al. : Nat. Cell Biol., 21(1), 9(2019).
3)Phinney, D. G. and Pittenger, M. F. : Stem Cells, 35(4), 851(2017).
4)Rajendran, R. L. et al. : Sci. Rep., 7(1), 15560(2017).
5)Lai, R. C. et al. : Stem Cell Res ., 4(3), 214(2010).
6)Nakai, W. et al. : Sci. Rep., 6, 33935(2016).
7)Ma, Y. et al. : Sci. Rep., 11(1), 13471(2021).
▍▏相关产品