【Wako】QCdetect™ 残留DNA检测试剂盒系列
生物药中的残留DNA检测
在生物制药的生产过程中,CHO细胞、大肠杆菌等生产用细胞系中宿主细胞携带的残留DNA可能会带来致癌性、传染性和免疫调控风险。
因此有必要对生物制品中外源宿主DNA残留量进行严格把控,相关的法律法规相继出台:
如WHO和美国FDA现行指导方针中,推荐成品中残留DNA不高于10 ng/剂;
美国FDA要求生物制品宿主细胞DNA残留量≤100 pg/剂;
《中华人民共和国药典》2020年版三部要求冻干乙型脑炎灭活疫苗(Vero细胞)DNA残留量应不高于100 pg/剂,乙型肝炎疫苗(CHO细胞)DNA残留量应不高于10 pg/剂。
而qPCR法具有极高的灵敏度、序列特异性和准确性,是现行中国药典中生物制品残留DNA检测的其中一种方法。针对残留DNA定量检测,FUJIFILM Wako可提供定量检测CHO细胞、大肠杆菌中残留DNA的qPCR试剂盒——QCdetect™ 系列。
QCdetect™ 残留DNA检测试剂盒,CHO细胞用
QCdetect™ 残留DNA检测试剂盒,
CHO细胞用
本品为适用于CHO细胞来源的残留DNA检测的qPCR试剂盒。
● 高灵敏检测:≥0.0003 pg
● 高线性的标准曲线
● 误差小,再现性高
● 使用预混合缓冲液,操作简单
● 不易受样品所含杂质的影响
● 含Internal Control(内标)

QCdetect™ 残留DNA检测试剂盒,
大肠杆菌用
本品为适用于大肠杆菌来源残留DNA检测的qPCR试剂盒。
● PCR Master Mix 的单管化节省配制试剂的步骤,提高检测通量
● 含内标,能够检测出程序性错误
● 能够高灵敏度地检测出基因组DNA

残留DNA提取试剂盒(碘化钠法)
此外,FUJIFILM Wako可提供符合中国药典标准的的残留DNA提取试剂盒(碘化钠法);
使用残留DNA提取试剂盒(碘化钠法),可高效率地回收样品中残留的极微量DNA,可配合QCdetect™ 系列检测和定量。
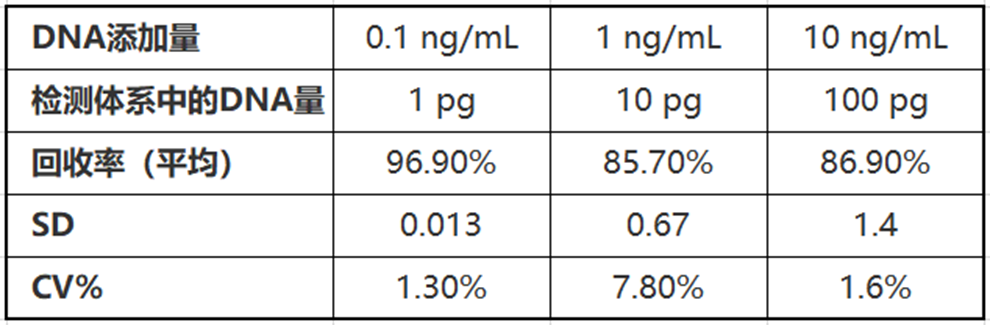
实验示例
使用DNA提取试剂盒(碘化钠法)提取,并配合QCdetect™ 残留DNA检测试剂盒检测大肠杆菌来源的基因组DNA。
【样品】
分别添加了1、10、100 ng/mL大肠杆菌来源基因组DNA的人γ-球蛋白溶液(浓度为75 mg/mL)。
【结果】
在高浓度蛋白的样品中,同样可实现高回收率的检测。
产品列表

※ 仅供实验研究用,不可用于临床诊断。
点在看,传递你的品味