【ScienCell】人小梁网细胞(HTMC)产品使用攻略
人小梁网细胞培养不成功、实验做不出来怎么办?新手小白迫切求助,希望各位前辈在文章下方留言,分享自己的经验,为小白们答疑解惑!
人小梁网细胞
(HTMC)
小梁网位于虹膜根部的周围,具有一个通向Schlemm's管的裂隙开口,将房水引流到静脉血管。小梁网细胞(TMCD)在房水外流中发挥积极作用,且该通路具有眼压依赖性。因此,TMC的损伤或死亡一直与开角型青光眼的发病机制相关。TMC进一步表达神经递质和神经肽的受体,并对极低浓度的多种血管活性肽和生长因子做出反应,使这些细胞能够在多个水平上调节小梁网的通透性。HTMC的培养为研究小梁网的功能控制提供模型,鼓励开发更有效的治疗青光眼的策略。HTMC分离自人眼的并耳管和角巩膜区域,可通过α-smooth muscle actin和fibronectin特异性抗体免疫荧光染色鉴定。
培养方式
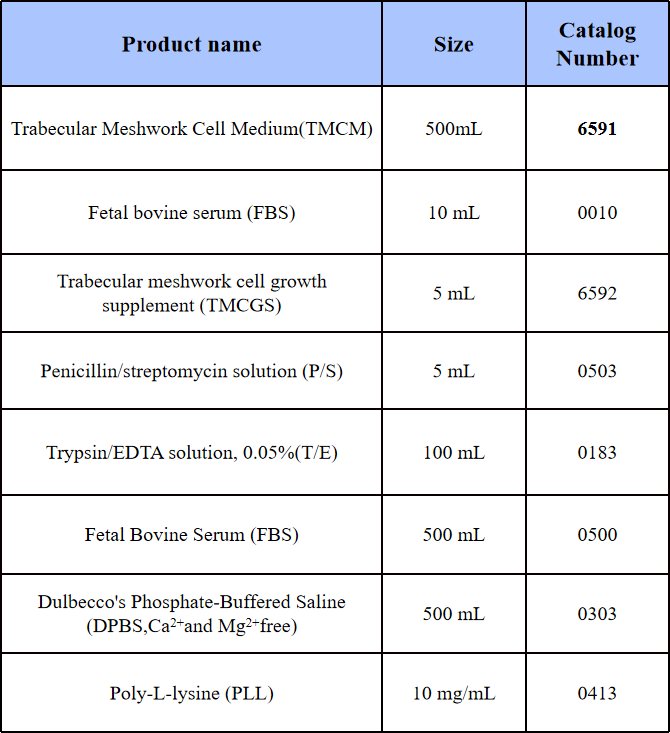
培养瓶:PLL(多聚-L-赖氨酸)包被的培养瓶。
培养基:HTMC用提供的TMCM完全培养基(包含基础培养基、2% FBS、1% TMCGS和1% P/S)中培养。
操作步骤:
1) 包被PLL(2 μg/cm2)培养瓶(T-75培养瓶)的准备:将10 mL无菌水加入到T-75培养瓶中,加入15 μL PLL原液,轻轻吹匀后将培养瓶放置在37°C的孵育箱中过夜(或至少1小时)。
2) 无菌水清洗包被PLL的T-75 2次,加入20 mL TMCM完全培养基(基础培养基、FBS、TMCGS和P/S按比例混合配制),将解冻后的HTMC加入至包被的T-75中,十字交叉法轻柔摇晃培养瓶使细胞分布均匀,将培养瓶放入细胞培养箱中。(注:不建议在解冻后稀释和离心细胞,因为这些操作对细胞的伤害比培养中残留的二甲基亚砜(DMSO)的影响更大。同时,将细胞置于PLL涂层培养有助于促进细胞附着。)
换液:为了获得最佳结果,在培养开始后至少16小时内不要干扰培养。第二天更换培养基,以去除残留的二甲基亚砜和未附着的细胞,之后每隔三天更换一次培养基,直到培养达到约70%的密度,一旦培养达到约70%的密度,每隔一天更换一次培养基,直到培养达到约90%的密度。
传代:当细胞密度达到90-95%时进行传代。
1) 将T/E、DPBS、培养基提前置于室温平衡(不建议37℃加热)。
2) 弃除旧培养基,并用DPBS清洗细胞后吸除加入5 mL DPBS和5 mL 0.05% T/E solution 轻柔晃动培养瓶后放入37℃培养箱,一段时间后镜下观察,待细胞完全变圆、脱落,轻轻拍打底部和侧面,加入2 mL FBS(#0500)终止消化,将细胞悬液转移至15 mL离心管中,1000 rpm离心5 min,用新培养基重悬细胞沉淀后计数,根据5000 cells/cm2的密度传代至预先用PLL包被的培养瓶中。
生长条件:在CO2浓度为5%,温度为37℃,相对湿度(RH)为95%的细胞培养箱中培养。
表1 HTMC培养材料
参考文献
[1] Stamer WD, Acott TS. (2012) “Current understanding of conventional outflow dysfunction in glaucoma.” Curr Opin Ophthalmol. 23: 135-43.
[2] Llobet A, Gasull X, Gual A. (2003) “Understanding trabecular meshwork physiology: a key to the control of intraocular pressure?” News Physiol Sci. 18: 205-9.
其他细胞品类
别划走,精彩继续

长按识别
添加一对一专属技术支持

扫码进群
咨询详细产品信息

点在看,传递你的品味












