【ScienCell】人脂肪微血管内皮细胞(HAMEC)产品使用攻略
人脂肪微血管内皮细胞培养不成功、实验做不出来怎么办?新手小白迫切求助,希望各位前辈在文章下方留言,分享自己的经验,为小白们答疑解惑!
人脂肪微血管内皮细胞
(HAMEC)
微血管内皮细胞覆盖在血管壁上,参与众多生物过程,如血管生成、凝血、淋巴细胞的转运和炎症反应。在不同器官和组织中微血管内皮细胞具有特定的细胞特征和功能。脂肪组织具有在成年期持续生长的能力和高水平的血管生成能力,为脂肪组织提供所需的广泛血管化。研究表明,血管生成先于脂肪生成,暗示微血管内皮细胞影响前体脂肪细胞的增殖。同时,脂肪细胞分泌的VEGF刺激微血管内皮细胞的生长,这表明微血管内皮细胞与前体脂肪细胞之间在组织发育过程中存在复杂的旁分泌关系。HAMEC分离自人的脂肪组织,其vWF/Factor VIII和CD31 (PECAM1)特异性抗体免疫荧光染色呈阳性。
培养条件
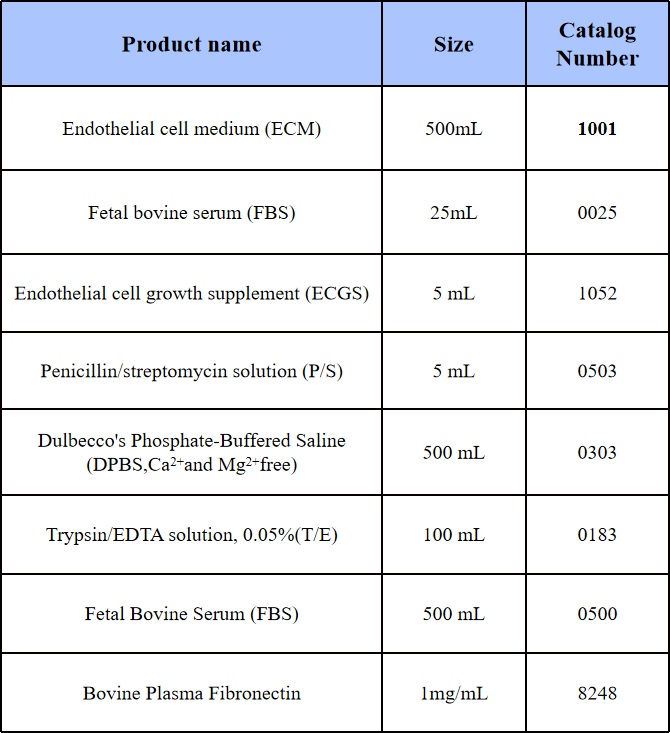
培养瓶:纤连蛋白(Bovine Plasma Fibronectin, 2 µg/cm2)包被培养瓶。
培养基:HAMEC在提供的ECM完全培养基(包含基础培养基、1% ECGS、5% FBS和1% P/S)培养。
操作步骤:
1) 包被纤连蛋白(2 µg/cm2)培养瓶的准备(T-75培养瓶):将10 mL无菌的Dulbecco's磷酸盐缓冲盐(DPBS)与150 µL纤连蛋白原液混匀后加入到T-75培养瓶中,将培养瓶放置在37°C的孵育箱中过夜(或至少2小时)。在铺细胞前将未凝固纤连蛋白溶液吸出(可重复使用2次),加入20 mL ECM完全培养基(基础培养基、ECGS和P/S按比例混合配制)。
2) 吸出未凝固的纤连蛋白溶液,T-75中加入20 mL的完全培养基,将解冻后的细胞小心加入到培养基中,十字交叉法轻柔平晃培养瓶。(注:不建议在解冻后对细胞进行稀释和离心,因为这些与培养物中残留DMSO的作用相比,这些作用对细胞的损伤更大;将HCPEC置于纤连蛋白包被的培养瓶中,促进生长同样重要。)
换液:培养开始后16小时内不要干扰培养。次日更换培养液,去除残留的DMSO和未贴壁细胞。之后每三天更换一次培养基,直到培养达到大约70%的密度。一旦培养达到大约70%的密度,每隔一天更换一次培养基,直到培养达到大约90%的密度。
传代:当细胞密度达到90%时进行传代。
1) 将T/E、包被培养瓶、DPBS、培养基提前置于室温平衡(不建议37℃加热)。
2) 弃除旧培养基,并用DPBS清洗细胞后吸除加入8 mL DPBS和2 mL 0.05% T/E solution 轻柔晃动培养瓶后放入37℃培养箱(注:原代细胞传代时请勿使用未稀释的胰蛋白酶),一段时间后镜下观察,待细胞完全变圆、脱落,轻轻拍打底部和侧面,加入2 mL FBS(#0500),将细胞悬液转移至15 mL离心管中,1000 rpm离心5 min,用新培养基重悬细胞沉淀后计数,根据5000-7000 cells/cm2的密度传代至预先用纤连蛋白包被的培养瓶中。
生长条件:在CO2浓度为5%,温度为37℃,相对湿度(RH)为95%的细胞培养箱中培养。
表1 HAMEC培养材料
参考文献
[1] Crandall DL, Hausman GJ, Kral JG. (1997) “A review of the microcirculation of adipose tissue: anatomic, metabolic, and angiogenic perspectives.” Microcirculation 4(2):211-32.
[2] Hutley LJ, Herington AC, Shurety W, Cheung C, Vesey DA, Cameron DP, Prins JB. (2000) “Human adipose tissue endothelial cells promote preadipocyte proliferation.” American Journal of Physiology: Endocrinology and Metabolism. 281(5):E1037-E1044.
[3] Hausman GJ, Richardson RL. (2004) “Adipose tissue angiogenesis.” Journal of Animal Science. 82(3): 925-934
其他细胞品类
别划走,精彩继续

长按识别
添加一对一专属技术支持

扫码进群
咨询详细产品信息

点在看,传递你的品味












