【Promega】线粒体功能检测:Mitochondrial ToxGlo™ Assay
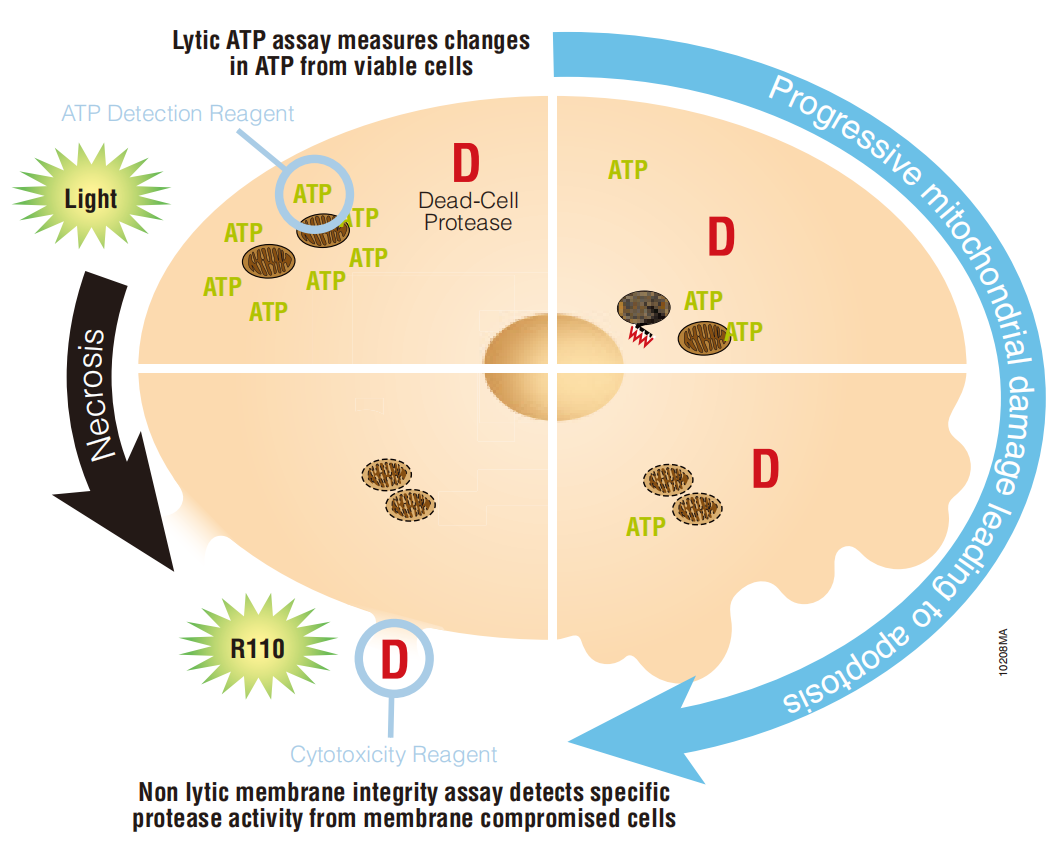
通过叠加检测细胞膜的完整性以及细胞内的 ATP 水平检测方法来预测外源化合物对线粒体功能异常的可能影响。
■ 反应原理
细胞膜的完整性是通过检测与细胞坏死相关联的一个独特的“死细胞蛋白酶”的活性来确定。ATP 的测定是通过加入 ATP 检测试剂来进行的。综合这两组数据,可以分析是线粒体功能异常还是非线粒体的细胞毒性相关的机制。
■ 产品特点
同一孔中叠加检测:同时检测 ATP(最能反映线粒体功能的检测方法)和细胞膜完整性的生物标志物,在同一样品孔中将原发性的线粒体功能障碍与继发性细胞毒性事件区分开来。
预测线粒体毒性:产生与线粒体毒性一致、并与其他引起细胞死亡的非线粒体机制区分开来的数据谱。
操作快速:简单的“加入-混合-读数”模式,在1小时内即可快速评估线粒体的潜在功能障碍。
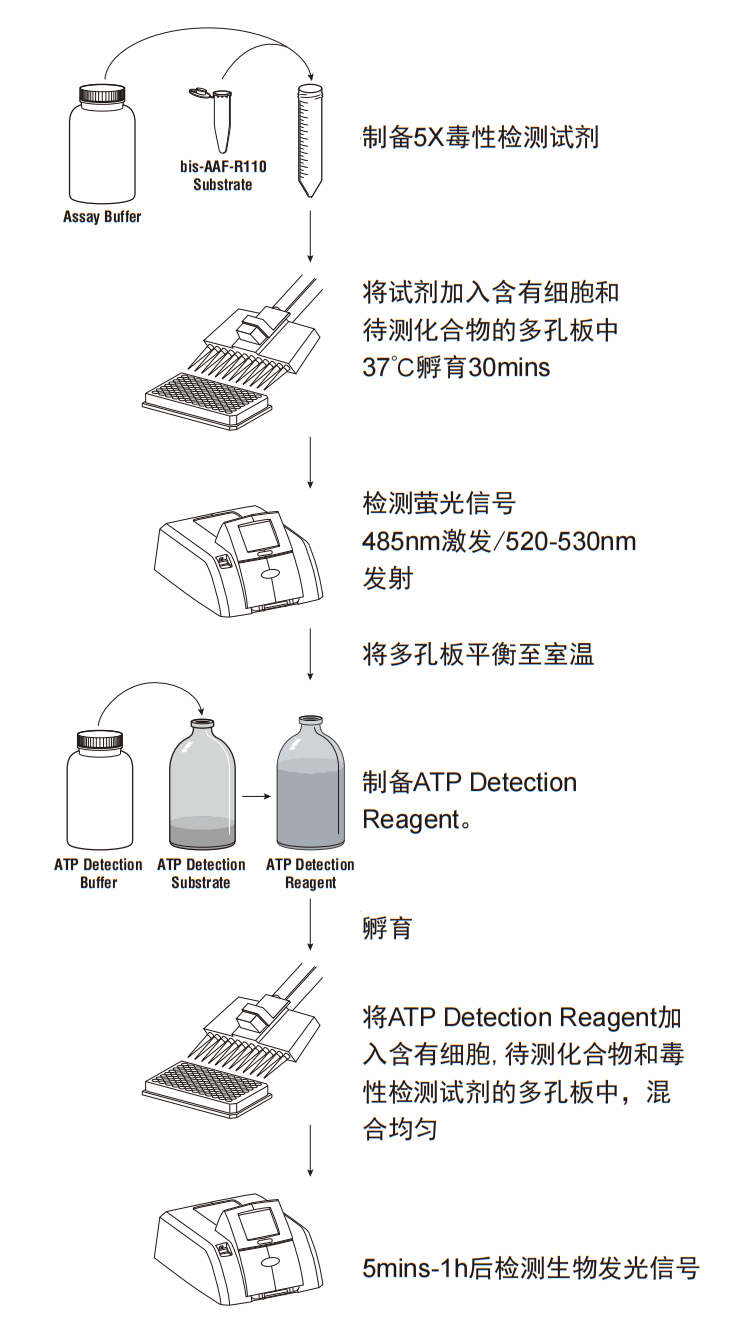
■ 操作步骤
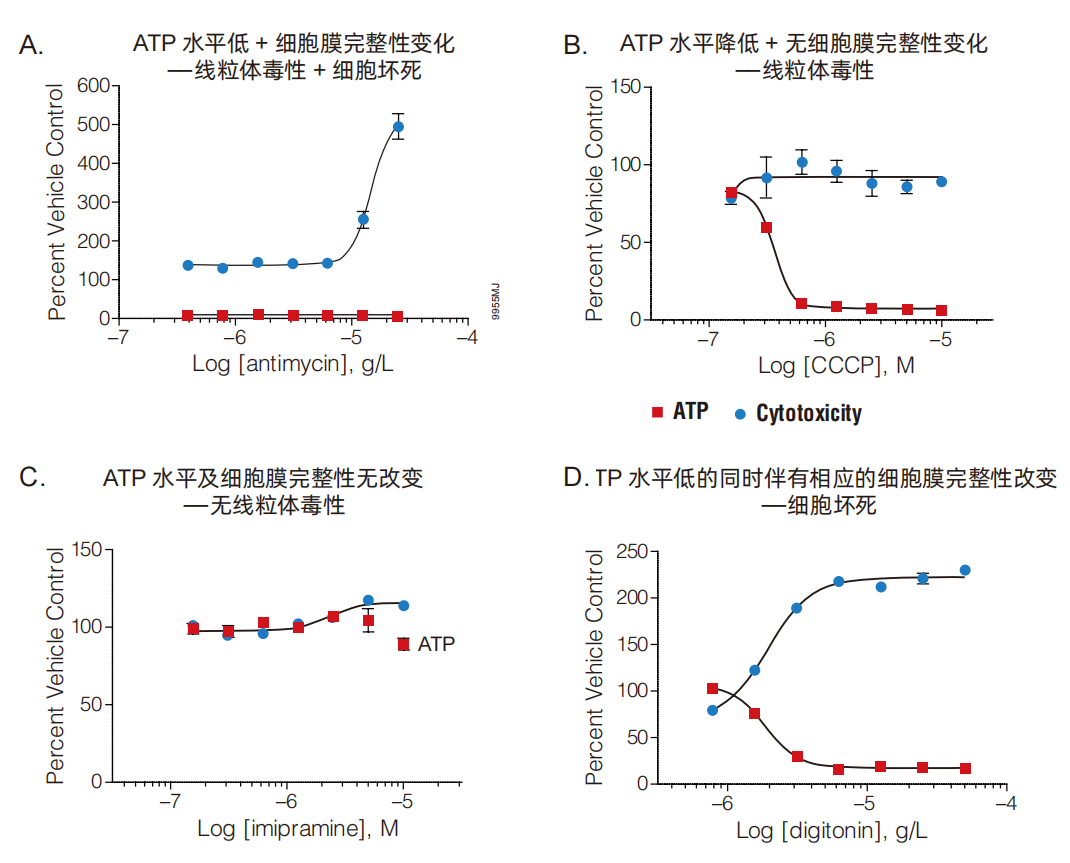
■实验举例

■应用:检测不同类型样本中的 ROS
检测 HepG2 Spheroids 微球体的甲萘醌 ROS 诱导反应
不同直径的 HepG2 球体对不同水平甲萘醌的反应。细胞在超低附着板(Corning)中孵育4天。用ROS-Glo™ HO:Assay 检测 H2O2的水平,并在 GloMax®Discover仪器上读取。
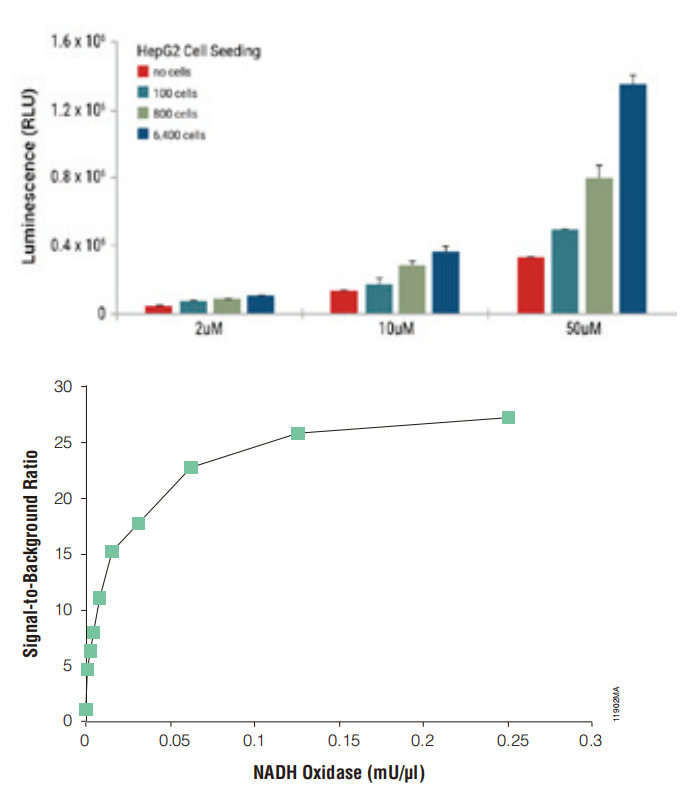
检测 NADH 氧化酶酶活性
通过将浓度升高的 NADH 氧化酶与 NADH 在酶反应缓冲液中一同孵育来测定 NADH 氧化酶酶活性,并通过 ROS-Glo™H2O2Assay 检测生成的 H2O2,从而确定 NADH 氧化酶活性。
在确定 NADH 氧化酶和 NADH 底物的适当水平后,该方法可以用于在化学文库中通过降低的发光信号来识别该酶的抑制剂。
检测培养细胞中的 ROS 诱导
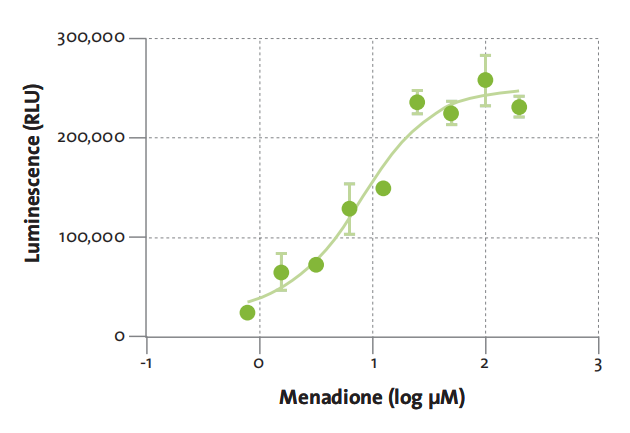
使用 ROS-Glo™ H2O2 Assay 检测甲萘醌处理所致的 K562 细胞中浓度依赖的 ROS 增加本试验可在各种的细胞培养基(含或不含血清)中进行,无需在进行本试验前将培养基从培养细胞中去除。
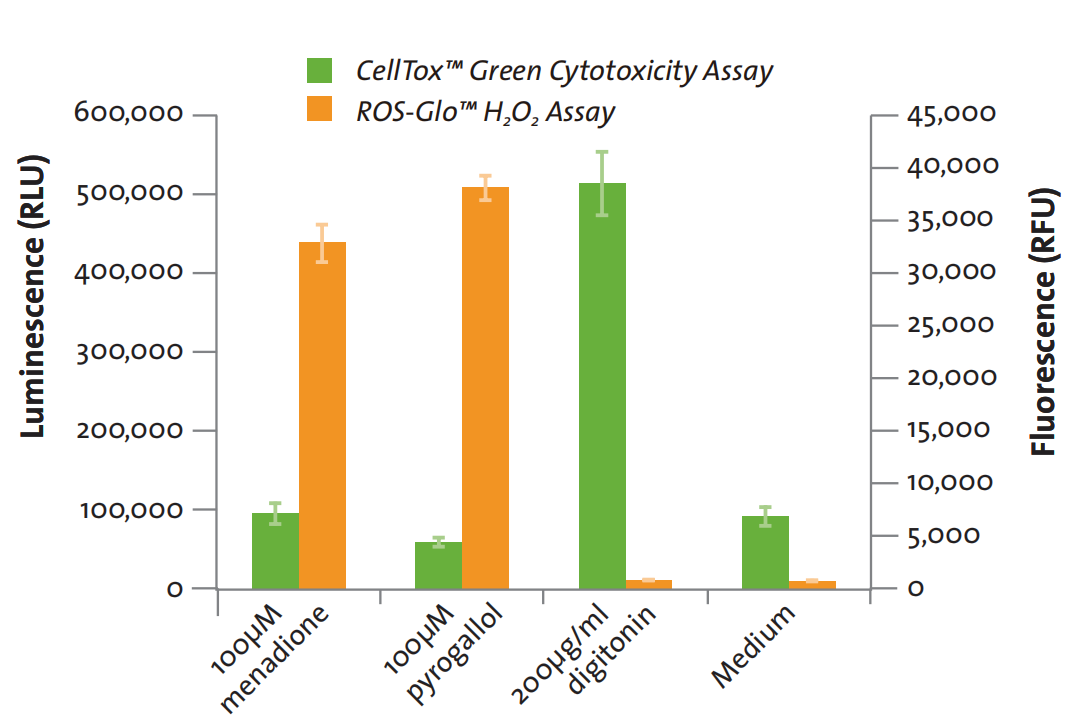
检测化合物对细胞影响-多重检测
HepG2 细胞用产生 ROS 的化合物(甲萘醌或邻苯三酚)或细胞毒性诱导试剂(洋地黄皂苷)处理,37℃孵育2小时。CellTox™ Green染料和H2O2底物在给药的时候添加。CellTox™ Green 染料孵育后检测荧光。然后加入 ROS-Glo™检测液,孵育 20 分钟后,检测发光信号。
点在看,传递你的品味














