【Merck】在Corning® 球形微孔板中对光学透明球状体进行3D成像
原理简介
近年来,由于与传统的二维(2D)单层培养物相比,三维(3D)细胞培养模型能够更准确地模拟体内环境,因此在体外药物发现试验中使用3D细胞培养物的案例急剧增加。然而,目前对这些3D养物的成像分析依赖于最初为2D细胞培养所开发的技术,因此具有很大的局限性。具体来说,由于这些球状体的直径通常>100µm,因此厚显微镜标本固有的光散射会阻止对整个3D球状体进行成像。这种技术限制在成像分析中会引入采样偏差,只能对球状体的外部细胞进行成像。为准确鉴定球状体的细胞环境和响应,该领域需要新技术来克服这种采样偏差。
因此,我们试图通过使用专为球状体设计的光学透明剂Visikol® HISTO-M™ 来补救由3D球状体不透明度所引起的光散射。本文介绍的高内涵筛选方法将Visikol HISTO-M组织透明剂用于在Corning 96孔球形微孔板中,形成HepG2球状体。
操作指南
在Corning® 球形微孔板中对光学透明球状体进行3D成像
一、试剂耗材准备
Visikol® HISTO-M™光学清洁剂(货号:HM-30/HM-100)
康宁® 球体微孔板(货号:CLS4515)
二、实验步骤
Corning球形微孔板中的球状体形成HepG2细胞在补充10% FBS的DMEM中进行常规培养。为形成球状体,将HepG2(1 x 103 个细胞/孔)接种到 96孔球形微孔
板的孔中,并在37°C,5% CO2的加湿培养箱中培养2天。
使用抗增殖化合物处理球状体
在DMSO中制备1 mM抗增殖化合物紫杉醇储备溶液。将DMSO原液进行10倍连续稀释制备工作溶液(100X),然后在生长培养基中稀释至最终测定浓度(1µM、500nM、100 nM、10 nM、1 nM)。在第0天和第3天再次用紫杉醇处理球状体。在实验前准备好所有需要的培养基和试剂。在冰上解冻3dGRO™ 类器官冷冻培养基。
固定和免疫标记
第5天,使用10%中性缓冲福尔马林原位固定球状体,然后在磷酸盐缓冲盐水 (PBS) 中洗涤以去除固定剂。用甲醇渗透球状体,然后用20% DMSO/甲醇提高抗体和染色剂的渗透性,再用10%驴血清进行封闭。在1:150兔抗 Ki67 抗体中孵育球状体以标记增殖细胞,然后使用Alexa Fluor® 488偶联的抗兔IgG二抗进行染色。细胞核使用DAPI进行染色。
球状体的透明化和高通量成像
使用Visikol HISTO-M对球状体进行透明化。简而言之,该过程首先通过与甲醇交换(200 µL/孔,15分钟)使球状体脱水,随后交换并转移到一步浸入式透明配方HISTO-M中,以进行浸入式透明化(200 µL/孔,30分钟)。最后,球形微孔板中浸入HISTO-M中对球状体可通过IN Cell Analyzer 6000 (Cytiva) 进行成像。在10X 放大倍率下,以5 μm的步长进行Z堆栈(~150 μm)成像。使用ImageJ处理图像,并使用CellProfiler对DAPI+和 Ki67+细胞进行计数。
结果和讨论
一、Visikol HISTO-M可实现球状体内部的可视化
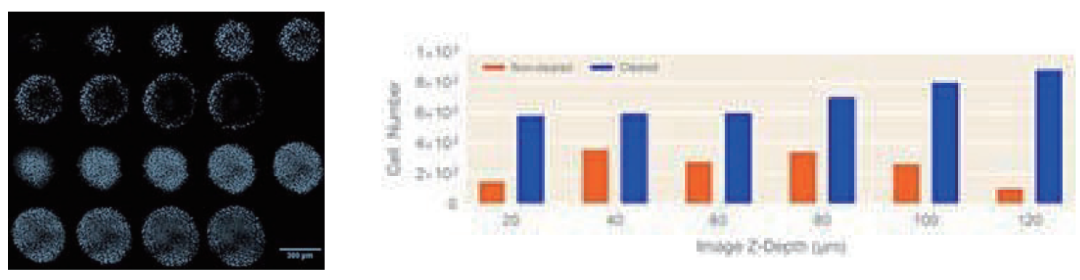
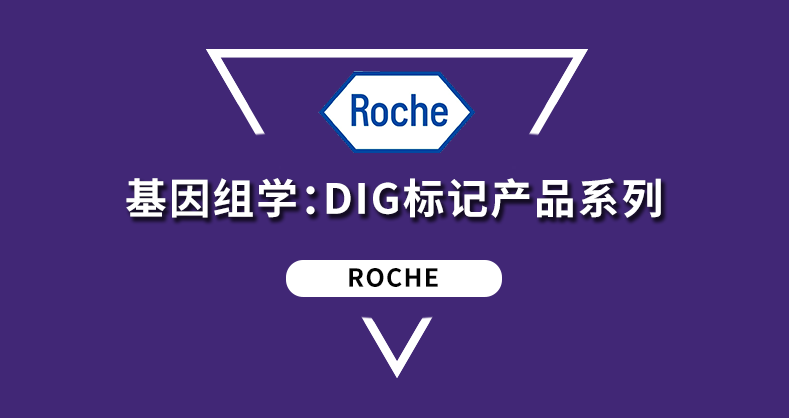
图1. DAPI染色球状体共聚焦Z堆栈的20 μM切片代表图像。(A)未透化(顶部行)和透化(底部行)球状体。比例尺=300 µM。(B)未透化 (橙色) 和透化 (蓝色) HepG2球状体在不同Z深度所检测到的细胞数。
图1A(顶行)的特征图像代表了3D细胞培养成像时遇到的困难。由于球状体的不透明度导致光散射大大降低了荧光信号,因此球状体的内部看起来很暗。仅能够从球状体最外层的细胞中检测到信号。相比之下,通过Visikol HISTO-M透明剂,光散射大大减少,透明化球状体中更明显的核荧光证明了这一点(图1A,底部行)。这有利于对球状体内部进行全面的分析。
二、Visikol HISTO-M可增加3D结构内部的可检测细胞数量
使用CellProfiler对共焦图像堆栈进行自动细胞计数。图1B对未透化球状体成像中存在的固有问题进行了定量。随着图像在未透化球状体中进行逐层采集,在每个平面中检测到的细胞越来越少,直到只能检测到外围细胞。由非透明球状体的不透明度引起的光散射将成像限制在大约20到50 µm,即使使用共聚焦显微镜也是如此。通过对球状体进行透化,可以在整个图像平面上检测到细胞,可深入球状体进行检测。平均来说,在透化球状体的每个平面上检测到的细胞比未透化球状体多3倍(图1B)。球状体越深效果越显著;在120 µm处,可检测到多7倍的细胞。
三、案例研究:HepG2 球状体的抗增殖测定
对照和紫杉醇处理的球状体成像如上,细胞增殖以Ki67+/DAPI+细胞与总细胞的比率(Ki67%)进行鉴定。通过构建未透化和透化球状体的剂量响应曲线(图2),证明球状体分辨率对增殖评估的影响。正如预期,由未透化和透化球状体构建的剂量响应曲线之间存在显著差异。相对于已透化球状体(图2A),未透化球状体中较高的Ki67%表明最外层细胞(未透化球状体中唯一可检测的细胞)的增殖水平高于内部种群。因此,由于采样偏差,未透化球状体中的增殖抑制人为地导致所用紫杉醇浓度更高。事实上,与检测未透化对照样品信号所需的100 nM相比,Visikol HISTO-M透化样品在检测抑制活性方面表现出更高的灵敏度,在1nM紫杉醇浓度下可检测到明显抑制(图2B)。用Visikol® HISTO-M (7.01nM) 透化的球状体所测定的IC50值比未透化的对照样品(29.6 nM) 计算的值低约4倍。透化样本中灵敏度的提高可归因于在透化球状体中,能够检测到在未透化条件下被掩盖的抑制效应。因此,使用Visikol HISTO-M进行组织透化消除了采样偏差,从而能够获得更能代表整个球状体并且可能更具生理相关性的数据。
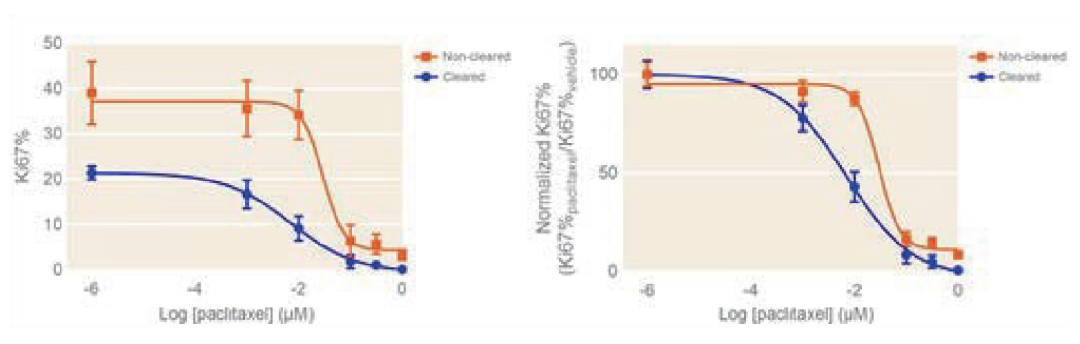
图2.未透化(橙色)和透化(蓝色)HepG2球状体的Ki67%剂量响应曲线。(A)紫杉醇处理的HepG2球状体的绝对Ki67%剂量响应曲线。(B)紫杉醇处理的HepG2球状体相对于载体处理的Ki67%归一化剂量响应曲线。平均值±SD,N=4。*p<0.01(单向ANOVA)。
四、空间剂量响应
通过对整个球状体进行采样,可以对3D结构内的微环境进行额外的下游分析。从透化的球状体中获得的数据可以根据与球状体中心的距离进行分组,以生成特定位置的剂量响应曲线。这有利于研究由于不同的细胞微环境引起的细胞增殖中的潜在差异反应。
在当前的研究中,是通过计算检测到的每个Ki67+核的中心点来完成的。每个球状体的中心点通过DAPI+原子核中心点的平均坐标进行计算。然后根据每个细胞到中心的相对距离对数据进行分组,将细胞分成3个同心壳:外三分之一(离中心最远)、中间三分之一和细胞内核。然后基于这些数据构建图 39所示的空间剂量响应曲线。
载体和紫杉醇处理的球状体中的三个细胞壳之间的细胞增殖水平存在显著差异。与图3中的数据一致,最外层细胞在载体对照中表现出最高水平的细胞增殖(约40%的细胞是Ki67+)。这些细胞表现出对紫杉醇处理的显著敏感性,在100nM紫杉醇处理下几乎完全抑制细胞增殖。细胞的中间壳具有较低的基底细胞增殖(图3A),但也显示出对紫杉醇处理的明显敏感性。最内层的细胞群具有最低的基线增殖水平。有趣的是,用1nM紫杉醇处理的最内层细胞群的细胞增殖显著增加(图3B)。这可能是由于外层细胞的死亡,揭示了一种新的营养通道并刺激了其他静止细胞的生长。然而,从这些结果中可以清楚地看出,在 3D球状体中检测抗增殖剂在不同细胞亚群中效果差异的能力是分析药物效果的一种宝贵工具。
图 3. 在HepG2球状体中测定的Ki67%空间剂量响应曲线。(A) 紫杉醇处理的HepG2球状体中三个细胞群的绝对Ki67%剂量响应曲线。(B)紫杉醇处理的HepG2球状体中三个细胞群的Ki67%相对于载体Ki67%的剂量响应曲线。平均值± SD,N= 4。*p<0.01(单向ANOVA)
五、Corning® 球形微孔板可实现更高通量的成像
传统的平底荧光检测微孔板有两大缺点。首先,球状体不能直接在检测板中进行培养,需要转移球状体,从而导致通量下降和数据丢失。其次,高内涵成像仪需要大量时间来检测5mm直径大孔中相对较小粒径的球状体(~300µm),尤其是在高放大倍率下。这也导致测定通量显著损失。Corning球形微孔板可以满足在同一孔板内进行球状体制备和分析,因此对于球状体成功高内涵成像至关重要。Corning球形微孔板(黑色/透明底)可提供96孔、384孔和1536孔形式,所有型号都可与自动化系统兼容。超低附着(ULA)表面是一种亲水、生物惰性和不可降解的涂层,共价附着在孔底的内表面,并可促进接种细胞自组装成3D 聚集体。独特的孔几何形状能够在微孔板上形成大小均匀的单个球状体。重要的是,球状体易沉淀在独特的U形孔的底部,因而可以减少找到球状体所需的扫描时间,从而简化并加速成像过程。不透明的侧壁和专有的网格板底部设计减少了孔间串扰和背景荧光/发光。球形微孔板的新颖和专有设计使它们成为一种3D细胞培养物高通量分析的理想工具。
此外,Corning® 球形微孔板与Visikol® HISTO-M 透化剂化学相容。Visikol透化过程仅需几分钟,可在球形微孔板孔内完成。本研究证明了组织透化在球状体培养物的成像分析中的优势。透化球状体使得扫描整个3D结构成为可能,从而更彻底地分析球状体内的微环境。简而言之,均匀的球状体可以在Corning球形微孔板中重复生成和培养、标记、透化和成像,而无需转移球状体,从而确保在不丢失信息或通量的情况下获得全面的数据集。
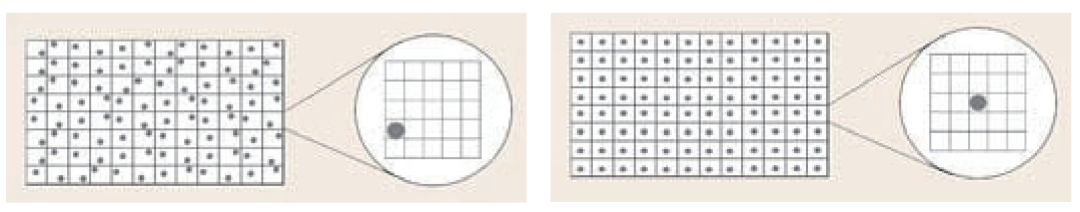
图 4. 传统平底微孔板与Corning® 球形微孔板中的球状体定位。传统的平底96孔微孔板会产生随机定位的球状体,因此高内涵成像仪必须扫描更大的区域才能找到需成像的球状体,从而降低了通量。Corning 96孔球形微孔板具有独特的U形孔底,可将球状体居中,从而加速图像采集。
结论
Visikol® HISTO-M可与球状体的免疫标记和荧光染色兼容。
• 使用Visikol® HISTO-M透化球状体可以显示球状体内部。
• 在高内涵共聚焦图像分析中,经过透化的球状体可提供高出3倍以上的细胞计数。
• 由于可检测到球状体的内部细胞,因此从Visikol® HISTO-M中获得的数据能够代表整个球状体。
• Corning® 球形微孔板的新型孔几何结构能够在高内涵筛选中对球状体进行高质量的自动成像,从而实现使用生理相关的3D模型在体外进行多重细胞健康分析。
其他细胞品类
别划走,精彩继续

长按识别
添加一对一专属技术支持

扫码进群
咨询详细产品信息

点在看,传递你的品味