【Merck】在AIM Biotech 3D细胞培养芯片上创建3D肾毒性模型
试剂耗材准备
产品编号 | 说明 |
HOL01 | AIM Biotech 3D Cell Culture Chip Holders |
LUC01 | AIM Biotech 3D Cell Culture Chip Luer Connectors |
DAX01 | AIM Biotech 3D Cell Culture Chips |
MTOX1030 | 肾脏PTEC控制细胞(SA7K克隆) |
MTOX1071 | 肾脏PTEC MDR1敲除细胞[MDR1敲除(-/-)] |
MTOXRCSUP | RPTEC Complete Supplement |
MTOXRTSUP | RPTEC Tox Supplement |
AIM Biotech提供了一个模块化平台,可以在离散的3D和2D通道中共培养多种细胞类型。使用人类细胞并兼具动物模型复杂性的器官型分析(例如免疫检查点、t细胞杀伤、血管生成、转移、细胞迁移、血脑屏障等)已被开发用于研究、药物发现和诊断。
实验步骤
肾脏毒性和清除模型
SA7K细胞系(MTOX1030)是一种伪永生化的人肾近端小管上皮细胞(RPTEC),使用CompoZr® Zinc Finger Nuclease技术从原代细胞发展而来。这些细胞被设计成可以避免细胞衰老,从而使细胞数量翻倍扩展。SA7K细胞呈现正常上皮细胞形态,表达典型的近端小管标志物(如CD-13和α-GST),并具有典型的近端小管功能,包括白蛋白摄取、γ-谷氨酰转肽酶活性、甲状旁腺激素引起的cAMP分泌增加,以及摄取和外排转运体的功能活动。
SA7K细胞在第0天装入AIM芯片。在第6天通过免疫荧光法分析细胞准确极化的能力。(图1-2)。
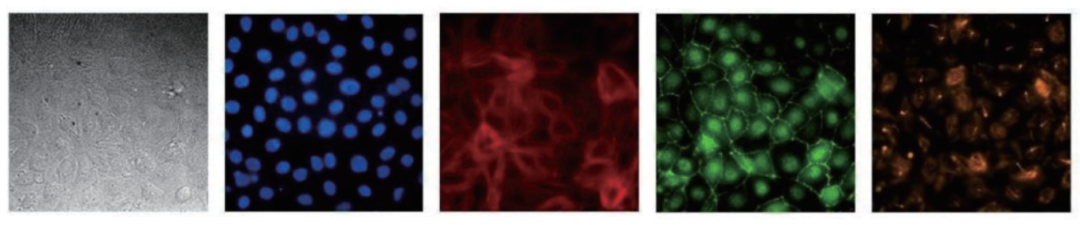
图1.肾近端小管上皮细胞系SA7K在AIM Biotech芯片上形成极化、紧密的屏障。将细胞装入AIM 3D细胞培养芯片,在无搅动的情况下生长6天。芯片中的细胞通过标准显微镜技术成像。在亮视野显微镜下图像显示经细胞核(Hoescht,蓝色)、F-肌动蛋白(鬼笔环肽,红色)、ZO-1(绿色)和乙酰化微管蛋白(橙色)染色的RPTEC。
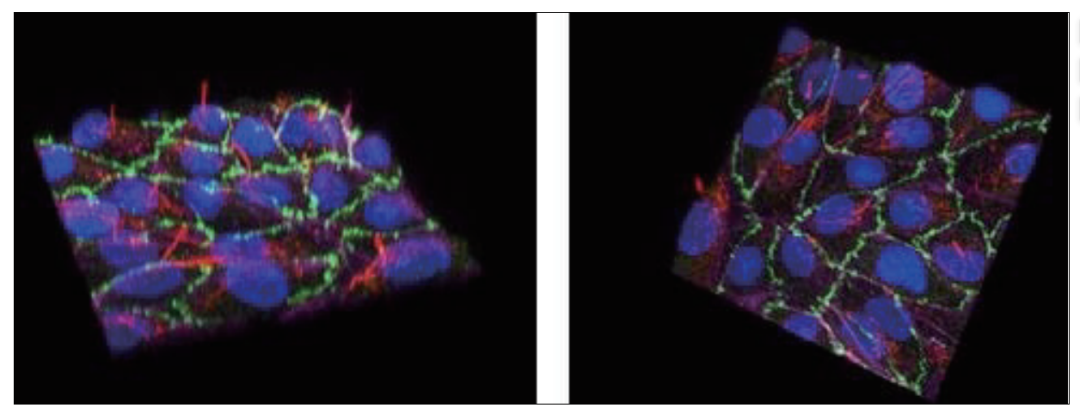
图2.肾近端小管上皮细胞系SA7K在AIM Biotech芯片上形成极化、紧密的屏障。将细胞装入AIM 3D细胞培养芯片,在无搅动的情况下生长6天。芯片中的细胞通过共聚焦显微镜成像。图像显示了经细胞核(Hoescht,蓝色)、F-肌动蛋白(鬼笔环肽,品红)、ZO-1(绿色)和乙酰化微管蛋白(红色)染色的RPTEC叠加。乙酰化微管蛋白染色在细胞的根尖侧,表明细胞在AIM芯片中被准确极化。
通过渗透率检测来量化屏障完整性
渗透率测定是确定屏障模型完整性最常用的方法。在这种渗透性试验中,将不同大小的染料添加到已建立的屏障中,并测量染料通过屏障的渗漏。将细胞通道中的染料量与相邻通道进行比较,可以得到表观渗透率的计算值,这表明屏障的紧密性。
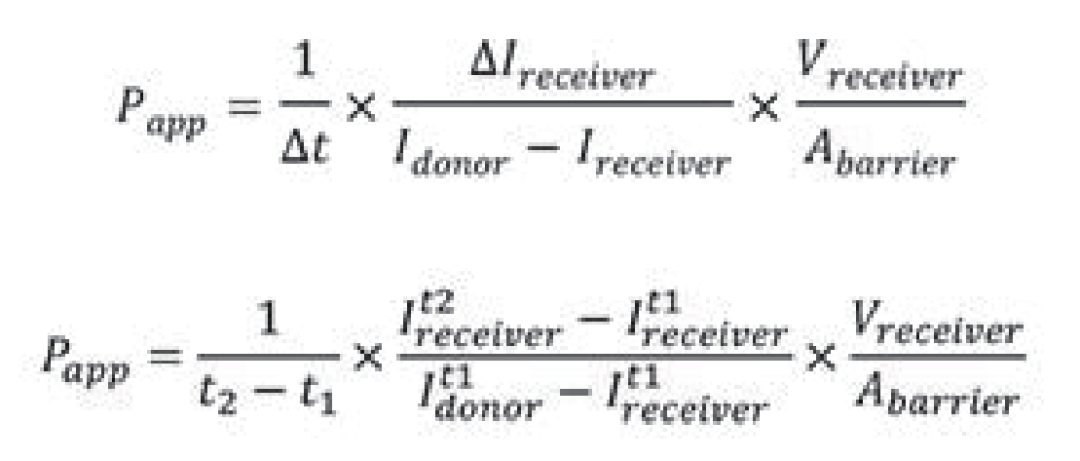
在第0天将RPTEC SA7K细胞装入AIM芯片,使其形成小管。第14天,染色剂进入细胞通道形成的小管腔。染料在腔内孵育10分钟。在时间0和10分钟后分别采集有细胞和染色的通道和相邻空通道的图像。染料的运动通过染料在每个通道中发出的光强度来衡量,在时间0和10分钟后进行测量。将测得的强度值输入表观渗透率方程,计算每种染料的表观渗透率值(图3)。

图3. AIM芯片上RPTEC SA7K的渗透率检测。将RPTEC SA7K细胞在AIM芯片上孵育14天后,在细胞通道的RPTEC管腔中加入Lucifer黄(MW 457.25)和tritc标记的葡聚糖(MW 3000)(用绿色和红色条形表示)。在开始时和染料在细胞通道中孵育10分钟后采集图像。染料通过RPTEC屏障的泄漏是通过比较相邻通道(由第一个面板中的黄色框识别)在时间0和10分钟的光强度来测量的。请注意,在第一个面板中标识相邻通道的黄色框仅用于说明,并不能准确地表示用于计算表观渗透率的框的面积。
使用下式,细胞通道(Idonor)和相邻通道(Ireceiver)的强度值与芯片面积和体积的测量值一起输入,以确定表观渗透率(Papp)。
在RPTEC SA7K AIM芯片平台中,Lucifer黄和TRITC测得的强度和计算得到的Papp值见表1。这两个Papp值都非常低,定量显示了在AIM芯片上电镀的RPTEC SA7K细胞形成的屏障的紧密完整性,无搅拌或剪切应力。
表1. AIM芯片内RPTEC SA7K屏障的表观渗透率。
产品编号 | Lucifer黄(MW 450 Da) | TRITC-右旋糖酐(MW 3000 Da) |
Ireceiver at Time 0 | 518 | 474 |
Ireceiver at 10 minutes | 694 | 510 |
Papp (cm/s) | 2.09x10-6 | 4.75x10-7 |
结论
AIM Biotech芯片的设计使三维微生理系统的设置变得容易。注射水凝胶和细胞的入口较大,便于装载和在平台上培养细胞。完整、紧密的小管结构的生长是建立肾脏清除模型所必需的。为了成功地制造出防漏电池屏障,电池需要沿着整个通道的长度分布。AIM 3D细胞培养芯片的设计和优化的培养方案使细胞均匀地分布在整个通道中,形成完整的小管。芯片的设计和聚合物结构可以对顶部和基底侧隔间进行采样,并生成高分辨率的相位和荧光图像。
RPTEC SA7K细胞在AIM 3D细胞培养芯片中形成管状结构。在细胞与细胞的边界处检测到紧密连接蛋白ZO-1,表明紧密屏障的形成。初生纤毛染色位于毛刷边缘,朝向管腔,用于确认小管内细胞的准确极化。将TRITC标记的葡聚糖(MW3000)和Lucifer黄(MW 457.25)两种荧光化合物注射到小管腔内,通过测量化合物通过屏障和进入凝胶通道的泄漏量来判断屏障的完整性。TRITC-右旋糖酐和Lucifer黄的Papp值分别为4.75x10-7cm/s和2.09x10-6cm/s,表明形成了一个紧密屏障。具有紧密屏障的肾小管的成功形成,使得AIM 3D细胞培养芯片中肾脏清除检测的开发成为可能。
其他细胞品类
别划走,精彩继续

长按识别
添加一对一专属技术支持

扫码进群
咨询详细产品信息

点在看,传递你的品味